Aquí, en esta segunda entrega, hablaremos de la síntesis del azul ultramarino en nuestro laboratorio, pero antes, explicaremos quién es el responsable de este brillante y vibrante color azul.
¿QUIÉN ES EL RESPOSANBLE DEL TONO AZUL EN LA AZUL UTRAMARINO?
Estructura de pigmentos ultramarinos
Los pigmentos ultramarinos son silicoaluminatos caracterizados por la estructura de la sodalita (Fig. 1) con especies cromóforas atrapadas en su interior. Su fórmula general es An[(Al,Si)12,O24] X2, donde A representan cationes no estructurales, generalmente Na+, K+, Mg+2, Ca+2; y X representa los aniones no estructurales como SO4-, SO3-, etc.
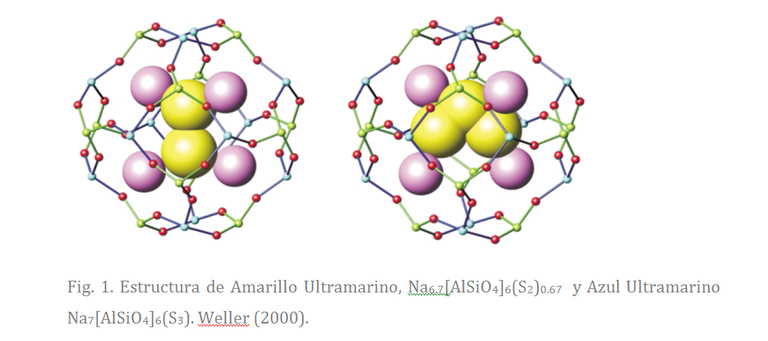
La Fig. 1 es una representación de la molécula amarillo ultramarino y azul ultramarino, derivada de un análisis S-edge EXAFS y difracción de rayos X. Las esferas amarillas representan los iones cromóferos, responsables del color: S2- y S3-, las esferas rosa representan los iones Na+, que se encuentras atrapados dentro de las cajas de la sodalita. Las esferas pequeñas verde, azul y rojo corresponden a átomos de Al de Si y O respectivamente que conforman la estructura de la sodalita.
La estructura del pigmento azul es más difícil de modelar debido a la posición desordenada del polianión trimérico con dos distintos tipos de azufre. Los átomos de Al3+ y Si4+ se encuentran distribuidos de forma desordenada en la estructura del aluminosilicato debido a la altas temperaturas de calcinación durante la síntesis del pigmento, mientras que en el pigmento natural se encuentra de forma ordenada.
En el pigmento azul ultramarino mayoritariamente hay NaS3, en el verde están presente tanto NaS3 como NaS2. Varios autores asignan a la especie S3-, el color azul y al S2- el color amarillo, otros autores hablan de la existencia de S4- al cual le atribuyen el color rojo; la concentración relativa de cada uno de estos iones en el pigmento, origina los diferentes tonos de estos pigmentos.
SÍNTESIS DE PIGMENTOS ULTRAMARINOS
A pesar de que muchas han sido las investigaciones orientadas al esclarecimiento de la constitución química de los pigmentos ultramarinos y de las reacciones químicas que gobiernan su síntesis; aún no se tiene un buen entendimiento de éstos y de la causa de sus diferentes colores. En líneas generales, el proceso de síntesis del pigmento azul ultramarino se lleva a cabo en dos etapas; una etapa de reducción en donde se forman los polisulfuros y la estructura del silicoaluminato obteniéndose un producto intermediario, “verde ultramarino”, caracterizado por la estructura de la sodalita que contiene en su interior especies S2- y S3-, y una etapa de oxidación en donde son transformados gran parte de los iones S2- presentes en la estructura a S3-.
Aparentemente en la etapa de reducción, el aluminosilicato y los polisulfuros de sodio se forman por separado. Según Gobeltz, et al. (1998), cuando el carbonato está en exceso (relación molar S/Na2CO3<3,3), sólo se forma S42-, pero cuando está en exceso el azufre se observa también la especie S5-2, siguiendo la ecuación (1) para este sistema. El tiosulfato formado, se descompone según la ecuación (2) a altas temperaturas (cercanas a 400 ⁰C). Sus resultados evidenciaron la desproporción o descomposición de los iones S4-2 y S5-2a los radicales S2- y S3-.
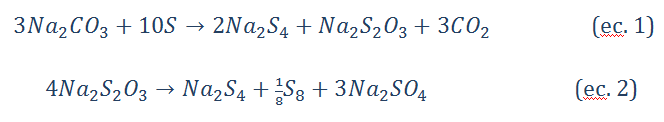
Seguido a la formación de los polisulfuros, se forma la caja de la sodalita entre los 600-700°C. Varias son las hipótesis propuestas acerca de la encapsulación de los polisulfuros dentro de la sodalita. Gobeltz et al. (1998), la inserción del cromóforo azul y el amarillo dentro de la estructura sodalita ocurre primero durante su formación; pero también ocurre después que la sodalita está formada por difusión hacia las cajas antes de la etapa de oxidación.
La etapa más importante en la producción de ultramarino sintético es la etapa de oxidación, y la calidad del ultramarino depende enormemente de su eficacia. La oxidación de verde ultramarino a azul se describe mediante la siguiente reacción:
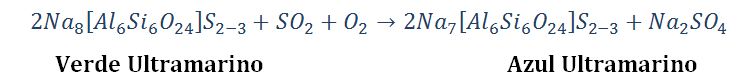
La oxidación del verde ultramarino es una típica reacción heterogénea entre las fases gas y sólido, resultando en la formación de una nueva fase sólida: azul ultramarino y sulfato de sodio. La interacción química de los gases con el verde ultramarino probablemente procede a través de una etapa de adsorción, la cual es reversible; mientras que la formación de azul ultramarino y sulfato de sodio es termodinámicamente un proceso irreversible.
SÍNTESIS DEL AZUL ULTRAMARINO EN NUESTRO LABORATORIO
Materiales
Reactivos: caolín nacional, azufre, coque, carbonato de sodio y potasio, nitratos de potasio, magnésio, cálcio, cobalto, manganeso, níquel y cinc.
Misceláneos: Crisoles de porcelana, mortero de porcelana, tamiz # 200, crisoles Gooch, kitazato, beackers, agitadores magnéticos, balones de una boca de 250 mL, balones aforados de 100 mL, condensadores, mangueras, baño de arena, termómetro, pinzas, bases universales, tubos centrifuga, desecante, espátulas, y vidrio de reloj.
Caracterización: los sólidos fueron caracterizados mediante las técnicas de difracción de rayos X (DRX), espectroscopia de infrarrojo con transformada de Fourier (FT-IR), microscopia electrónica de barrido (MEB) y reflectancia difusa de Uv-visible. Estos datos no serán presentados en este capítulo pero estarán a disposición de los interesados si lo solicitan.
Síntesis del pigmento
El caolín nacional recibió un tratamiento previo antes de ser utilizado en para la síntesis. Se secó por 24 h a 80 ⁰C, se molió y se calcinó a 650/850°C.
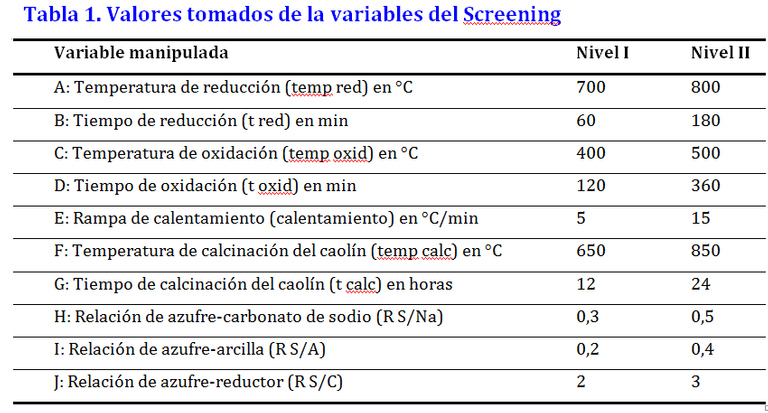
La etapa de síntesis fue optimizada utilizando para ello dos diseños de experimentos diferentes; el primero fue un diseño tipo Screening de 2 niveles y de 10 variable independiente (Tabla 1). Con este diseño se escogieron las variables que ejercieron mayor influencia en la tonalidad del pigmento en la región estudiada y con el proceso implementado. El segundo diseño, es una optimización tipo Simplex realizado con las variables seleccionadas del diseño tipo Screening. El mismo permitió determinar el valor de cada variable en donde se obtuvo el color más parecido al pigmento comercial.
El procedimiento de síntesis consistió en la mezcla de las cantidades adecuadas de cada materia prima de manera que cumpliesen con las relaciones indicadas en la Tabla 1 y una masa total de mezcla de 4,5 g. Se colocó dicha mezcla en un crisol de porcelana con tapa y se llevó a un horno eléctrico tipo mufla. La mufla se calentó hasta la temperatura de reducción a la rampa de calentamiento indicada en el diseño, y se dejó a esa temperatura el tiempo estipulado para la reducción. Completado este tiempo, se permitió que la mufla se enfriara hasta la temperatura de oxidación. Alcanzada la temperatura de oxidación se destapó el crisol manteniéndolo de esa manera hasta cumplirse el tiempo estipulado para el proceso oxidativo. La purificación del pigmento obtenido se llevó a cabo hirviéndolo cinco minutos en una solución de carbonato de sodio 0,1 M. Luego se filtró en caliente y se lavó con abundante agua caliente. Finalmente se secó el sólido a 80 ⁰C por 24 h. El refinado se realiza para asegurar un tamaño de partícula pequeño y uniforme. Para esto, el pigmento purificado se pasó por un tamiz de 75 micras (mesh # 200). El siguiente esquema indica un modelo simplificado del proceso experimental (Fig 2).

Resultados
La Fig. 3, ejemplifica los resultados obtenidos según el diseño experimental obtenido. Tal como se puede observar, la variación de los factores conduce a diferentes colores. Esto nos ha permitido el diseño de diferentes colores a la “carta” según lo deseado por el fabricante. Nuestros sólidos fueron caracterizados por diferentes técnicas, y los sólidos obtenidos mantuvieron la estructura deseada.

Finalmente un diseño experimental Simplex, y tomando en cuenta las variables más importantes e influyentes nos permitieron obtener el color azul deseado (Fig. 4)

Conclusiones
La realización de este trabajo permitió establecer las siguientes conclusiones:
** Los factores que ejercen mayor influencia en color del pigmento sintetizado en este trabajo son la relación S/Na, seguido del tiempo de reducción, temperatura de reducción, disminuyendo la diferencia de color al aumentarse. La relación S/Arcilla también es significativa pero contrario a las anteriores, aumenta la diferencia de color al incrementarse. Existe interacciones dos factores en el sistema estudiado siendo significativas las presentadas entre la temperatura de reducción y la relación S/Arcilla, entre la temperatura de reducción y la rampa de calentamiento del horno, la del tiempo de reducción con la relación S/Arcilla, relación S/Na y rampa de calentamiento, y relación S/Na con relación S/Arcilla. No son significativos en la región estudiada la temperatura y tiempo de oxidación, la rampa de calentamiento, la temperatura y tiempo de calcinación de la arcilla, y la relación S/C.
** Las condiciones óptimas para la síntesis de ultramarino son, temperatura de reducción en 798°C, tiempo de reducción de 465 min, temperatura de oxidación 400°C, tiempo de oxidación 120 min, rampa de calentamiento a 5°C/min, temperatura de calcinación 850°C, tiempo de calcinación 12 h, Relación S/Na de 0.46, relación S/Arcilla de 0.42 y relación S/C de 3.
Referencias
BELVER, C., y otros: (2004), “Materiales con propiedades tecnológicas obtenidos por modificación química de un caolín natural”, Boletin de la Sociedad Española de Cerámica y Vidrio, 43 (2), 148-154.
GOBELTZ N., et al: (1998), “Correlation between EPR, Raman and colorimetric characteristics of the blue ultramarine pigments”, Journal Chemical Society, Faraday Trans., 94(5), 677-681.
GOBELTZ N., et al:: (1998), “Encapsulation of the chromophores into the sodalite structure during the synthesis of the blue ultramarine pigment”, Journal Chemical Society, Faraday Trans., 94(15), 2257-2260.
GOBELTZ N., et al:: (1998), “Identification of the products of the reaction between sulfur and sodium carbonate”, Americam Chemical Society, Inorg. Chem., 37, 136-138.
JANKOWSKA Aldona, S. Kowalak: (2008). “Synthesis of ultramarine analogs from erionite”, Microporous and Mesoporous Materials, 110, 570-578.
KOWALAK S., et al: (2005), “Influence of cations on color and structure of ultramarine prepared from zeolite A”, Studies in Surface Science and Catalysis, 158, 215-222.
TORTOSA A. (2010) “Síntesis de pigmentos inorgánicos tipo azul ultramar a partir de materia prima nacional”, Tesis de Maestría, Universidad de Carabobo,
WELLER, Mark: (2000), “Where zeolites and oxides merge: semi-condensed tetrahedral frameworks”, Journal Chemical Society, Dalton Trans., 422, 7-4240.
Biografía: Lic. en Química Universidad Central de Venezuela (UCV). Dr en Química UCV. Profesor titular UC.
Saludos @clinares, al subir contenido usando la etiqueta #stem-espanol debes garantizar que tu contenido cumpla con las pautas y normas de publicación de la comunidad, te dejaré estos enlaces para que consultes sobre normas y directrices,. Nos seguimos leyendo
https://steemit.com/stem-espanol/@stem-espanol/presentacion-stem-espanol
https://steemit.com/stem-espanol/@carloserp-2000/directrices-sobre-normas-de-derechos-de-autor-en-steemstem-stem-espanol
Gracias @lupafilotaxia. Otra cosa, una vez que se suba, es posible modificar el contenido para que cumpla con las pautas?
Saludos @clinares, recuerda que tienes la opción de EDITAR.
Leí los contenidos de ambos enlaces, muy interesantes... Pero, por favor, dame una pista en lo que esté fallando. Casi todo el contenido de lo que me enviaste está relacionado con el derecho de autor en la imágenes y pienso que cumplí con las exigencias relacionadas con ese sector. Pero quizás tú estés viendo algo que se me está pasando. Gracias
Saludos @clinares, te recomiendo leer manuscritos publicados con la etiqueta #stem-espanol, allí observaras detalles y puedes encontrar pautas, de acuerdo a lo que encuentro en tu post, trata de dar crédito a las imágenes que usas para crear tus Figuras , pues aún cuando son tus esquema las imágenes pueden o no tener derecho de autor (intenta subir fotos inéditas, aprovecha y toma fotos en los procedimientos de laboratorio) , revisa que las etiquetas estén escrita de forma correcta, fíjate que en este caso escribiste de forma incorrecta Streemstem, cuando realmente es Steemstem sin la R., busca un estilo para transcribir ideas originales dando los crédito cuando sea necesario.
Gracias @lupafilotaxia . Si, después me di cuenta de algunos detalles.