Seguramente en algún momento te habrás preguntado ¿qué color de camisa o zapatos quieres comprar para esa noche tan especial? O tal vez, haz estado con la indecisión de cual pantalón quieres usar si el azul o el negro. Pero tal vez, nunca te hayas preguntado cómo es el proceso para que existan esos dos colores de camisas que tanto te gustan.
Una vez más les traigo un post para demostrarles que la química se encuentra en todos los aspectos de nuestra vida. Y es porque precisamente me encontré decidiendo que color quería vestir hace unos días, y me pregunte ¿Sabrán los miembros dé #Steemit y #Stem-espanol que para dar las diferentes tonalidades al material textil se requiere de varias reacciones químicas? Entonces quise orientarlos en el tema y les traigo una experiencia práctica con resultados para el enriquecimiento intelectual.
 Colores
Colores Los colorantes son combinaciones de elementos orgánicos que al ponerlos en contacto con diversos materiales comparten o transmiten su color siempre y cuando se presente afinidad entre ellos para absorber.
Los compuestos coloreados absorben luz en la región visible del espectro electromagnético su color es complemento de la región donde absorbe debido a que esto es resultado de la luz reflejada o transmitida. Por otro lado las superficies incoloras y blancas no absorben luz n la región del visible y las de color negro absorben todas las longitudes de onda. En post anteriores explique detalladamente como ocurre los saltos electrónicos responsables de la absorción de energía, estos pasan de un estado de menor energía a uno de mayor energía. La intensidad de la luz visible es capaz de promover transiciones permitidas entre orbitales pi y pi* y es por esto que diferenciamos entre los colores.
Introducción
Los pigmentos azoicos son comúnmente utilizados en la industria textil para colorar los diferentes tipos de telas. Esto debido a la facilidad de su obtención utilizando compuestos de anilinas que son muy accesibles económicamente y pueden obtenerte varios colores por estos métodos con muchas propiedades químicas y físicas favorables para esta industria. Las reacciones químicas que se desarrollan para obtener los colorantes se denominan Diazotación y copulación.
La primera es un proceso donde se hace reaccionar una amina aromática o alifática con nitrito de sodio en medio ligeramente acido para obtener la respectiva sal de diazonio. Y la segunda es una reacción común de sustitución electrofílica que ocurre entre la sal de diazonio formada en la primera reacción y un anillo aromático de las aminas.

Color
Los colorantes azoicos presentan un grupo “azo” como parte de su estructura y estos son colorantes artificiales. Estos son mucho más estables que los colorantes naturales. Y se encuentran en una gama de colores vivos y fuertes comúnmente utilizados en reacciones ácido-base. Estos compuestos se conocen como anilinas, estos poseen la propiedad de transmitir su propio color a otros tipos de materiales como los textiles. De este tipo se han reportado una variedad de colores derivados de hidrocarburos bencénicos y fenólicos.
Las sales aromáticas de diazonio son compuestos orgánicos muy estables que son empleado en síntesis orgánicas para crear colorantes de diferentes naturalezas. Estas tienen la de estructura general es R−N2+X−, donde R puede ser un alquilo o un arilo, y X es regularmente un anión haluro. El grupo AZO une dos anillos aromáticos, que comparten 6 pares de electrones deslocalizados.
Para obtener la diazotación se debe estar en presencia de nitrito de sodio en medio ácido y acuoso, como con ácido nitrosilsulfurico, clorhídrico o sulfúrico. (1)
Como objetivo se mantuvo; sintetizar diversos colorantes azoicos a partir de la diazotación de diferentes aminas y acoplamiento de éstas con un compuesto común: 2-naftol.
Metodología experimental
Preparación de 2-naftolato
Se preparó una disolución de 3 gramos de NaOH (0,075 moles) en 27 ml de agua. Luego se pesó 1,44 gramos de 2-naftol (0,01 moles) y se disolvió en la disolución de hidróxido sódico.
Diazotación
Aproximadamente 0,725 gramos de nitrito sódico (0,010 moles) se disolvieron en 5 ml de agua. En un matraz Erlenmeyer, se pesó 1,2 gramos de amina y se añadió 45 ml de agua. Posteriormente lentamente se adicionó 12 ml de HCl concentrado en agitación hasta que la amina se disolvió. Esto se hizo en un baño de agua de hielo.
Mientras la disolución se mantuvo a 5 ºC, lentamente, se agregó (con cuenta gotas), y con agitación, la disolución de nitrito sódico
Copulación
Se añadió lentamente a la disolución alcalina de 2-naftol la disolución de sal de diazonio. Una gran cantidad de precipitado rojo apareció durante la adición. Se filtró la mezcla al vacío y se secó en la estufa para luego tomar el punto de fusión.
RESULTADOS Y DISCUSIÓN
En ésta experiencia, primero se obtuvo de la sal de diazonio a partir de la anilina, lo cual, en reacción con ácido clorhídrico y nitrito de sodio, se formó como intermediario de reacción (1) denominado N-nitrosoamina, mecanismo 1 que con la transferencia de un protón (tautomería) del nitrógeno al oxígeno y luego ocurrir la protonación del grupo hidroxilo, seguida de pérdida de agua da lugar al catión diazonio (2) que es relativamente estable a temperaturas menores de 5°C, por lo que se mantuvo la reacción en hielo para evitar la descomposición y luego realizar la copulación. La formación de la sal de diazonio aromática obtenida se rige bajo el siguiente mecanismo de reacción:
Se debe mencionar que el grupo R mostrado en el mecanismo no estaba presente, ya que se trabajó con anilina.
Diazotación
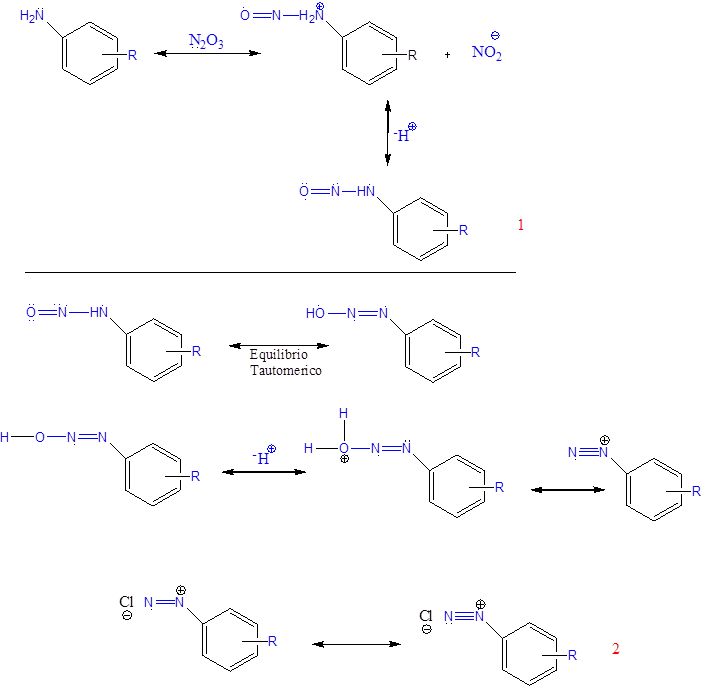
Mecanismo de formación para sal de diazonio aromática- Fuente: Elaboración propia
El compuesto 2 era un líquido amarillento, que fue la sal de diazonio que se utilizó inmediatamente para la formación del compuesto 3 con la anilina presente y la solución de 2-naftol se observó una coloración naranja rojiza muy brillante y viscosa, obteniéndose el 1-(fenildiazenil)-naftalen-2-ol por reacción de acoplamiento al agregar el hidróxido de sodio el color característico del compuesto deseado.
Se observa que el compuesto 1 tiene pares de electrones libres estos son responsables de los cambios de tonalidades en los diversos colorantes y en un espectrograma de ultravioleta-visible cambia las intensidades a las que absorben los cromóforos. Ellos no otorgan el color pero si lo modifican y son conocidos como grupos auxocrómicos. Si estos grupos funcionales donan pares de electrones trasladan en el espectro UV a mayores longitudes de onda, es decir como se muestra en la Tabla 1. Hacia los azules y verdes y son llamados grupos batocrómicos entre los que se encuentran NH2, NR2 , NHR, OH. Por otra parte si los grupos son aceptores de pares libres de electrones trasladan el máximo de absorción a menores longitudes de onda y los colores mostrados son los amarillos y naranjas como muestra la tabla. Estos grupos son nombrados como hipsocrómicos algunos ejemplos con el NO2 y COOR.

La reacción inicia con el ataque del enlace pi del anillo aromático con pares de electrones en resonancia a la sal de diazonio, la cual por polarización de uno de los enlaces, neutraliza la carga positiva del nitrógeno central, produciendo el compuesto Diazo 3. El mecanismo de reacción de la copulación desarrollado se muestra en la siguiente figura:
Copulación

Mecanismo de reacción de copulación para la formación del 1-(fenildiazenil)-naftalen-2-ol - Fuente: Elaboración propia
El compuesto 3 se denomina 1-(fenildiazenil)-naftalen-2-ol y presentó la coloración naranja característica y la reacción que se muestra a continuación

Reacción desarrollada- Fuente: Elaboración propia
A los cristales ya seco del compuesto naranja, se les tomó el punto de fusión dando como resultado 130 ºC, quedando demostrado un buen rendimiento y una buena técnica realizada ya que el punto de fusión teórico de este compuesto es 132 -132.5.

Colorante obtenido- Elaboración propia
Se procedió a realizar una prueba de tinción donde se agregó unos trozos de tela blanco en una solución de NaOH al 15% y se coloca a 90 ºC durante 15 minutos, luego se lavaron los cristales abundantes de la tela con agua, y la tela quedo de un naranja más pálido como se muestra debajo. Esto demuestra que el colorante fue capaz de teñir la tela de muestra.

Colorante obtenido sobre tela blanca- Elaboración propia
Disposiciones finales
La reacción de diazotación fue puesta a punto por Peter Griess en 1860. Esta reacción tiene lugar entre una amina primaria aromática y NaNO2 en presencia de HCl o H2SO4, para formar una sal de diazonio. Este procedimiento se llevó a cabo para la obtención del anaranjado II, logrando obtener un punto de fusión de 130 ºC.
Como este procedimiento existen muchos para obtener diferentes colores partiendo de los compuestos derivados del grupo azo. Espero mi post les halla dejado interes y conocimientos en el tema. Saludos queridos lectores. y Recuerden
Un día sin conocimiento adquirido es un día perdido
Referencias bibliográficas
- Beyer y Walter, Manual de química orgánica, versión española, editoria reverte. 1987 Alemania
- Morrison, R. T., Boyd, R. N. 1985. “Química Orgánica”. Quinta Edición en Español. Editorial Addison Wesley. México. 660-662.
- Wade, J. R. 2004. “Química Orgánica”. Quinta Edición en Español. Editorial Prentice Hall. Madrid. 405-408.
Nyc
Saludos
Me parece tan curioso como no ponemos atención a las cosas que tenemos alrededor y la repercusión de la ciencia en nuestras vidas. Damos todo por sentado. Gracias por ilustrarnos.
Saludos. Razón tienes al decir que pasamos por alto muchos aspectos de la ciencia en nuestro día a día.
Hola @viannis, post muy creativo, una buena manera de demostrar que la química forma parte de todos los aspectos de nuestra vida. saludos !
Saludos estimado @amestyj Gracias por leer mi post.
Agradecida @viannis de los aportes tan enriquecedores que les brindas a la comunidad. Adoro la química, así que sinceramente gracias por enseñarme con tan ilustrativos artículos acerca de esta hermosa ciencia. Saludos.
Hola amiga @maurelvys gracias por tomar el tiempo de leer y comentar. Y pues la quimica es simplemente hermosa. :D
Muy interesante @viannis, gracias por educarnos es temas tan del día a día y que no nos detenemos a pensar en toda la ciencia que esconden.
Saludos @elvigia gracias por leerme.
Un buen artículo, y esas palabras de cierre "Un día sin conocimiento adquirido es un día perdido"., encausan lo que representa este post en lo particular. Saludos estimada @viannis.
Saludos amiga @lupafilotaxia. Siempre he creído que debemos aprender algo nuevo cada día.
Hola @viannis. ¿Al teñir una tela siempre queda el color con menos intensidad? Saludos.
Saludos estimado. Generalmente la intensidad del color disminuye un poco. Sin embargo estos colorantes deben ser mezclados con algunos estabilizantes, retardantes y fijadores para garantizar el color de manera permanente.
Una vez más, excelente aporte para la comunidad. Feliz día.
Feliz dia. Gracias por leerme siempre.
Para mi este no es un día perdido. Todos los días aprendo algo nuevo. Adelante y éxitos con tus investigaciones Felicitaciones