A toda la comunidad de Hive, mis cordiales saludos. Particulares saludos para todos mis Hive-Lectores y Hive-Seguidores. En la presente oportunidad les comparto el post que he titulado GAS IDEAL, GAS REAL Y EL TRABAJO REALIZADO POR UN GAS.
Además de hacer llegar un poco de ciencia a la comunidad de Hive en general espero, con el presente contenido, seguir contribuyendo con la formación de aquellos estudiantes que, por el COVID-19, deben seguir sus estudios en casa.
Es pertinente, mis Hive-Lectores, que tengan presentes mis siguientes posts durante el estudio del actual:

Mis estimados Hive-Lectores, antes de hablarle del trabajo que puede ser llevado a cabo por un gas, les hablaré del Gas Ideal y del Gas Real:
1.- GAS IDEAL:
1.1.- DEFINICION:
Un Gas Ideal o Gas Perfecto, mis atentos Hive-Lectores, es aquél que posee las siguientes características (vean la figura 1):
- El número de moléculas es despreciable comparado con el volumen total de un gas (baja densidad).
- No existen fuerzas de atracción o repulsión entre sus moléculas.
- No existe colapso entre las moléculas ni cambios en su naturaleza física (cambios de fase).
- Las moléculas del gas ideal ocupan siempre el mismo volumen a las mismas condiciones de presión y temperatura.
- Su energía cinética es directamente proporcional a la temperatura.
- Las colisiones de las moléculas que lo componen (entre sí o con las paredes del recipiente) son de tipo elástico (se conserva el momento y la energía cinética).

Gif animado realizado por mi persona, @tsoldovieri, usando las aplicaciones Paint y PhotoScape
Supongo, mis estimados amigos Hive-Lectores, que a esta altura se dieron cuenta que: un gas con las anteriores características no existe en la naturaleza, de allí su denominación de ideal o perfecto. Sin embargo, con suficiente enrarecimiento (baja presión), cualquier gas real se aproxima, por sus propiedades, a un gas ideal. Ciertos gases, tales como el aire, nitrógeno, oxígeno, incluso a condiciones normales, es decir, a temperatura ambiente y presión atmosférica, poco se diferencian de un gas ideal. En particular, por sus propiedades, el helio e hidrógeno se aproximan a un gas ideal.
Un gas ideal se supedita a la ecuación,
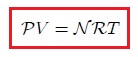
que es la denominada Ecuación de Estado de un Gas Ideal. Aquí 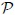 es la presión,
es la presión, 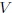 el volumen,
el volumen, 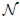 el número de moles de gas,
el número de moles de gas, 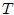 es la temperatura en la escala Kelvin y
es la temperatura en la escala Kelvin y 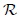 es la constante universal de los gases, encontrada experimentalmente igual para todos los ellos. En la siguiente tabla se muestra el valor de
es la constante universal de los gases, encontrada experimentalmente igual para todos los ellos. En la siguiente tabla se muestra el valor de  en algunas combinaciones de unidades:
en algunas combinaciones de unidades:
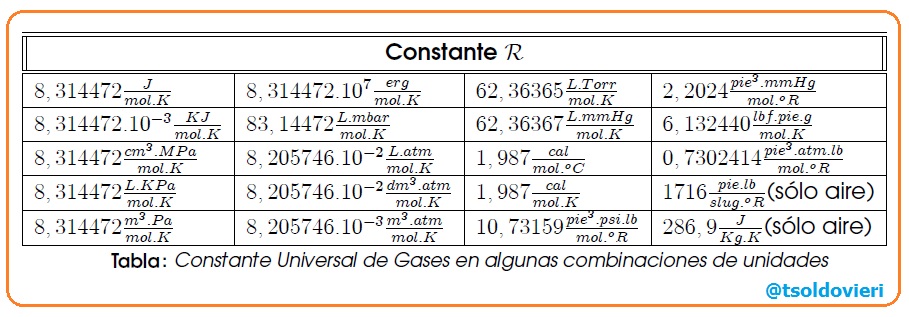
1.2.- LEYES DE LOS GASES IDEALES:
Mis estimados Hive-Lectores, para los gases ideales se pueden distinguir tres leyes. Estas leyes se originan al establecer ciertas condiciones sobre la expresión (1) y son: la Ley de Boyle, la Ley de Charles y la Ley de Gay-Lussac (vean la figura 2).

Gif animado realizado por mi persona, @tsoldovieri, usando las aplicaciones Paint y PhotoScape
1.2.1.- LEY DE BOYLE - MARIOTTE:
Amigos Hive-Lectores, si reducimos la presión externa sobre un globo, nos damos cuenta que el mismo aumenta de tamaño, es decir aumenta su volumen, siendo ésta la razón por la que los globos meteorológicos se expanden a medida que se elevan en la atmósfera. Lo mismo ocurre con las bulbujas de aire en el agua, mientras más suben mayor es su tamaño, ya que la presión externa disminuye a medida que la profundidad sea menor. Por otro lado, cuando un volumen de un gas se comprime, la presión del gas aumenta.

Fuente y Autor desconocido - Dominio público - FuenteGif animado realizado por mi persona, @tsoldovieri, usando las aplicaciones Paint y PhotoScape. Retratos: De Johann Kerseboom - Dominio público -
La Ley de Boyle-Mariotte, o simplemente Ley de Boyle, fue formulada independientemente por el físico y químico británico Robert Boyle en 1662 y el físico y botánico francés Edme Mariotte en 1676 (vean la figura 3). Esta ley se enuncia como sigue:
Para una cierta masa fija de gas a temperatura constante, al aumentar el volumen, la presión del gas disminuye y al disminuir el volumen, la presión del gas aumenta. Es decir, el volumen es inversamente proporcional a la presión. |
|---|
Fuente>Gif animado realizado por mi persona, @tsoldovieri, usando las aplicaciones Paint y PhotoScape. Basado en el gif de NASA's Glenn Research Center - Dominio público -
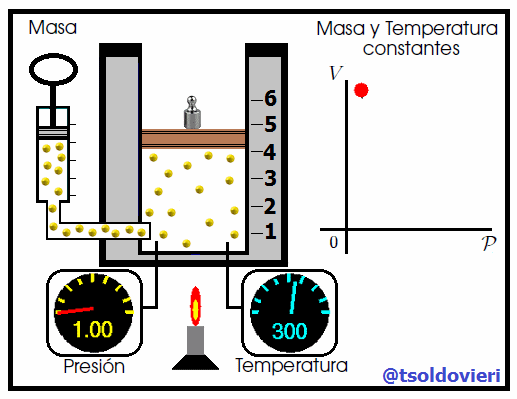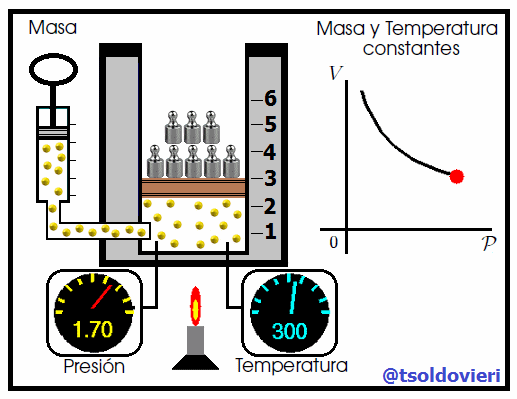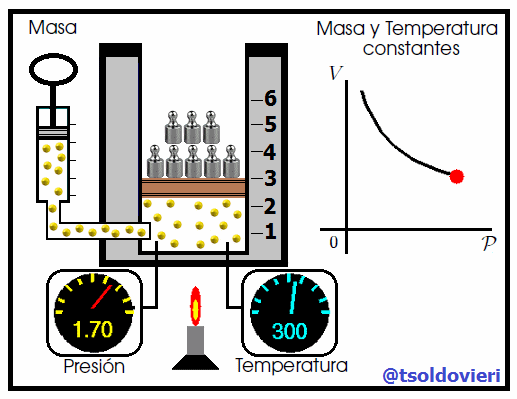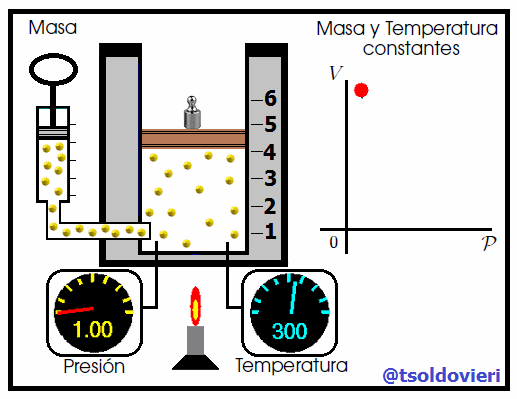
Mis atentos Hive-Lectores, en la figura 4 les muestro un caso donde se cumple la ley de Boyle. Observen que la temperatura y la masa se matienen constantes, mientras que la presión se hace variar mediante la adición de pesas. A medida que aumenta la presión, disminuye el volumen y viceversa. Matemáticamente se expresa mediante,

que también suele escribirse como,
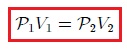
donde los subíndices 1 y 2 indican los valores de la presión y el volumen en dos estados distintos.
1.2.2.- LEY DE GAY-LUSSAC:
Si tenemos, por ejemplo, un recipiente de aluminio sin líquido y lo sellamos con solamente el aire que contenía, al aumentar la temperatura externa el aire en su interior aumenta de volumen hasta que llegar a estallar. Por el contrario, si llegamos a enfriarlo lo suficiente, podríamos hacer que el recipiente colapse sobre sí mismo.

De François-Séraphin Delpech - Dominio público - Fuente
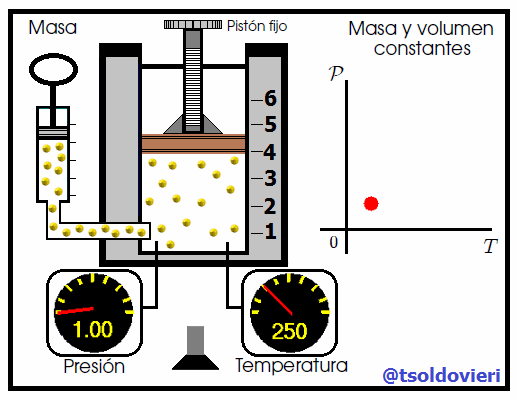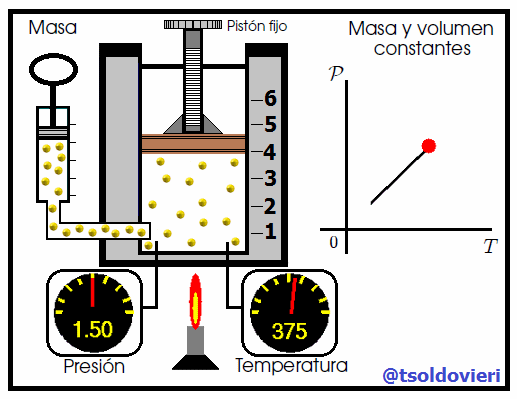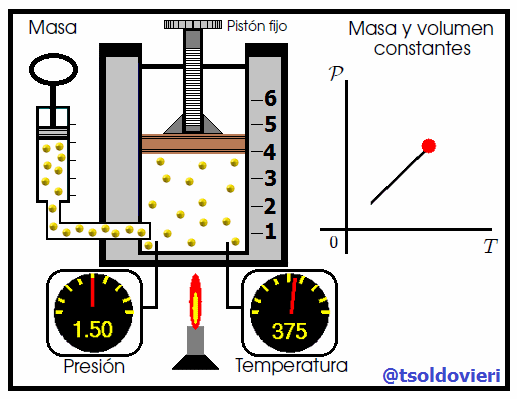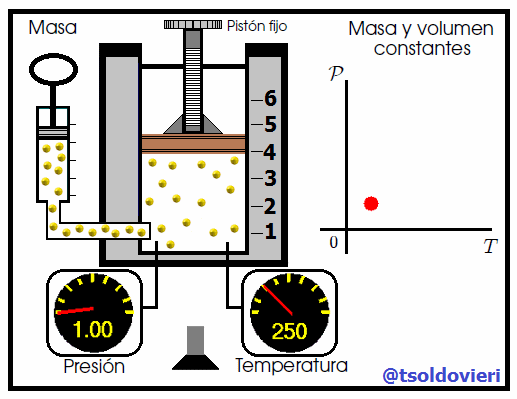
La relación entre la temperatura y la presión fue enunciada por el químico y físico francés Joseph Gay-Lussac (vean la figura 5) en 1802. Esta ley se enuncia como sigue:
Para una cierta cantidad de gas a volumen constante, al aumentar la temperatura, la presión del gas aumenta y al disminuir la temperatura, la presión del gas disminuye. Es decir, la presión es directamente proporcional a la temperatura. |
|---|
Gif animado realizado por mi persona, @tsoldovieri, usando las aplicaciones Paint y PhotoScape.
Mis atentos Hive-Lectores, en la figura 6 les muestro un caso donde se cumple la ley de Gay-Lussac. Observen que el volumen y la masa se mantienen constantes, mientras que la temperatura se hace variar mediante el aumento del calor suministrado. Al aumentar la temperatura, aumenta la presión y viceversa. Matemáticamente se expresa mediante,

que también suele escribirse como,
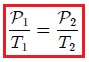
1.2.3.- LEY DE CHARLES:
Mis estimados amigos Hive-Lectores, cuando se calienta el aire contenido en los globos aerostáticos éstos se elevan, porque el gas aumenta de volumen. El aire caliente que está dentro del globo es menos denso que el aire a menor temperatura del entorno, a la misma presión, la diferencia de densidad hace que el globo ascienda. Similarmente, si un globo se enfría, éste disminuye de volumen.

Autor desconocido - Dominio público - Fuente
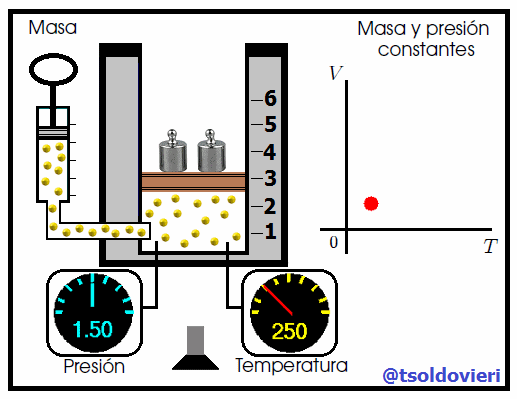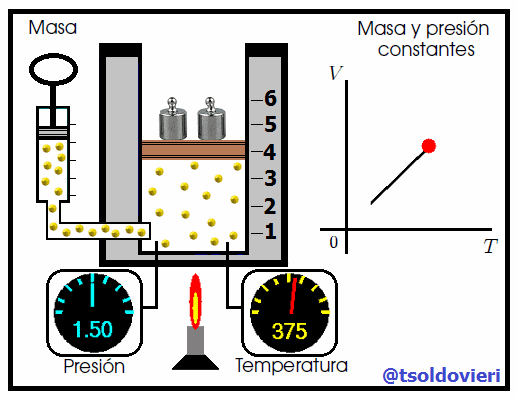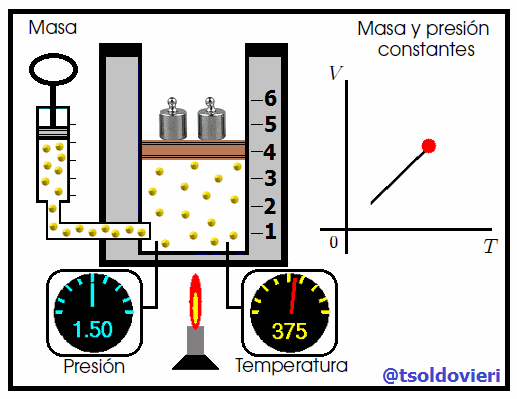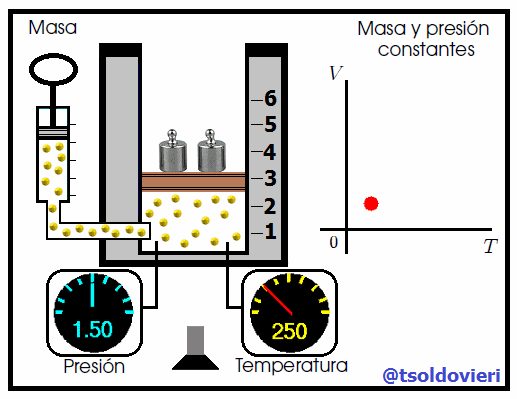
La relación entre la temperatura y el volumen fue enunciada por el científico francés Jacques Charles (vean la figura 7), utilizando muchos de los experimentos realizados por Joseph-Louis Gay-Lussac. Esta ley se enuncia como sigue:
Para una cierta masa fija de gas a una presión constante, al aumentar la temperatura, el volumen del gas aumenta y al disminuir la temperatura, el volumen del gas disminuye. Es decir, el volumen es directamente proporcional a la temperatura. |
|---|
Fuente>Gif animado realizado por mi persona, @tsoldovieri, usando las aplicaciones Paint y PhotoScape. Basado en el gif de NASA's Glenn Research Center - Public Domain -
Mis atentos Hive-Lectores, en la figura 8 les muestro un caso donde se cumple la ley de Charles. Observen que la presión y la masa se mantienen constantes, mientras que la temperatura se hace variar mediante el aumento del calor suministrado. Al aumentar la temperatura, aumenta el volumen y viceversa. Matemáticamente se expresa mediante,

que también suele escribirse como,
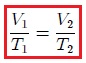
2.- GAS REAL:
Amigos Hive-Lectores, la ecuación de estado del gas ideal (1) no es del todo correcta: los gases reales no se comportan exactamente así. En algunos casos, la desviación puede ser muy grande. Por ejemplo, un gas ideal nunca podría convertirse en líquido o sólido por mucho que se enfriara o comprimiera.

Autor desconocido - Dominio público - Fuente
Por lo anterior, se han propuesto modificaciones de la ley de los gases ideales. Una de ellas, muy conocida y particularmente útil, es la ecuación de estado determinada en 1873 por físico holandés Johannes Diderik Van der Waals (vean la figura 9),
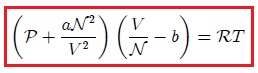
donde 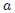 y
y 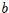 son parámetros ajustables determinados a partir de medidas experimentales en gases reales. Son parámetros de la sustancia y no constantes universales, puesto que sus valores varían de un gas a otro. Por ejemplo, para el
son parámetros ajustables determinados a partir de medidas experimentales en gases reales. Son parámetros de la sustancia y no constantes universales, puesto que sus valores varían de un gas a otro. Por ejemplo, para el 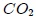 el mejor ajuste se obtiene para
el mejor ajuste se obtiene para 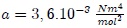 y
y 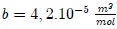 .
.
El análisis de Van der Waals se basa en la Teoría Cinética de los Gases y toma en cuenta:
- El tamaño finito de las moléculas: en un gas ideal se desprecia el volumen total de las propias moléculas, en comparación con el volumen total del recipiente, suposición que se aparta de la realidad cuando la densidad aumenta y las moléculas se juntan.
- Las moléculas interaccionan entre sí: la interacción es muy repulsiva a corta distancia, se hace ligeramente atractiva a distancias intermedias y desaparece a distancias más grandes. La ley de los gases ideales debe corregirse para considerar las fuerzas atractivas y repulsivas. Por ejemplo, la repulsión mutua entre moléculas tiene el efecto de excluir a las moléculas vecinas de una cierta zona alrededor de cada molécula. Así, una parte del espacio total deja de estar disponible para las moléculas en su movimiento aleatorio. En la ecuación de estado, se hace necesario restar este volumen de exclusión
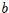 del volumen del recipiente; de ahí el término
del volumen del recipiente; de ahí el término 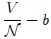 (en un gas ideal se supone que las fuerzas intermoleculares actúan sólo durante las colisiones, cuando las moléculas están en "contacto").
(en un gas ideal se supone que las fuerzas intermoleculares actúan sólo durante las colisiones, cuando las moléculas están en "contacto").
Los gases reales se subordinan a la ecuación de Van der Waals sólo de forma aproximada. Un gas imaginario que por completo se supedita a la ecuación (8) recibe el nombre de Gas de Van der Waals. |
|---|
3.- TRABAJO REALIZADO POR UN GAS AL EXPANDIRSE:
Amigos Hive-Lectores, supongamos que se tenemos un gas confinado en un recipiente cilíndrico mediante un pistón o émbolo de superficie 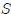 que puede moverse sin rozamiento, como el que muestro en la figura 10.
que puede moverse sin rozamiento, como el que muestro en la figura 10.
Gif animado realizado por mi persona, @tsoldovieri, usando las aplicaciones Paint y PhotoScape
Se debe tener cuidado en definir con exactitud el sistema. En este caso elegimos al gas como sistema, de tal modo que las paredes del recipiente y el émbolo son partes del medio circundante (entorno). Se calculará el trabajo que efectúa el gas al expandirse cuasiestáticamente, con lo que se quiere decir que la transformación se lleva a cabo con extrema lentitud (ver CONCEPTOS FUNDAMENTALES DE LA TERMODINAMICA - PARTE 3), de manera que el sistema pasa por una sucesión de estados de equilibrio infinitesimalmente cercanos. En esta forma, las variables termodinámicas 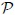 y
y 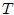 se definen en el sistema en todos los instantes. Cuando el gas se expande, ejerce una fuerza
se definen en el sistema en todos los instantes. Cuando el gas se expande, ejerce una fuerza 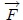 sobre el pistón. Para que la transformación pueda ser cuasiestática, esta fuerza debe ser compensada por una fuerza contraria, aplicada por algún dispositivo externo. Para conducir la transformación hay que disminuir y luego controlar esta fuerza compensatoria con mucho cuidado de tal forma que el pistón se mueva lentamente de la posición inicial a la posición final.
sobre el pistón. Para que la transformación pueda ser cuasiestática, esta fuerza debe ser compensada por una fuerza contraria, aplicada por algún dispositivo externo. Para conducir la transformación hay que disminuir y luego controlar esta fuerza compensatoria con mucho cuidado de tal forma que el pistón se mueva lentamente de la posición inicial a la posición final.
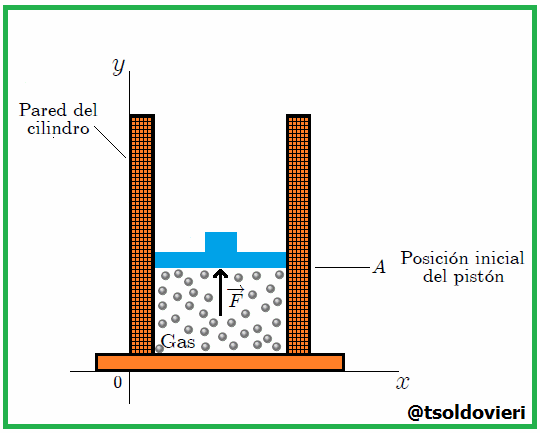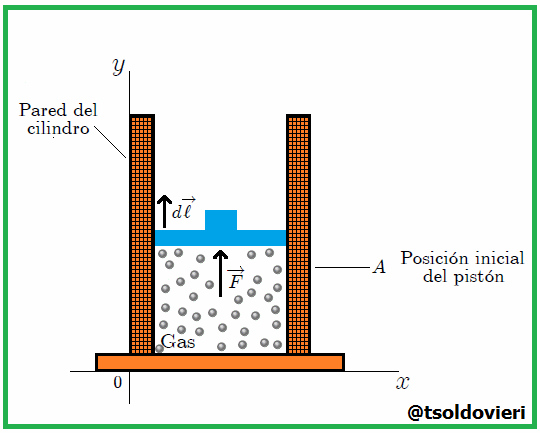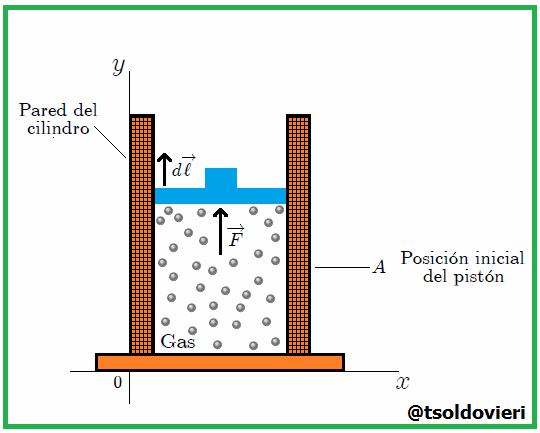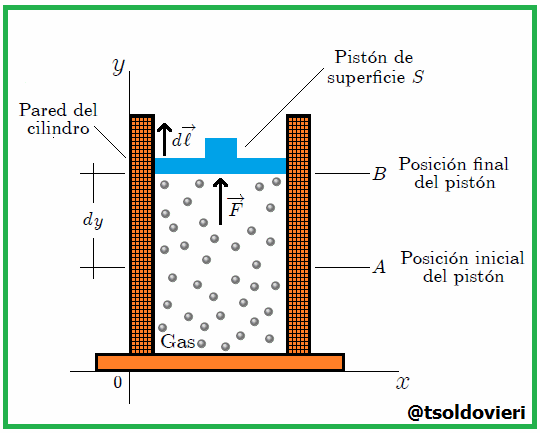
Si el gas se expandiera o comprimiera rápidamente, habría turbulencia y partes diferentes estarían a diferente presión y temperatura. Por efecto de la presión 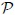 ejercida por el gas el pistón experimenta, como les mencioné antes, una fuerza
ejercida por el gas el pistón experimenta, como les mencioné antes, una fuerza 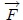 que lo desplaza desde una posición inicial
que lo desplaza desde una posición inicial 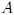 a una posición final
a una posición final 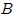 , mientras recorre una distancia
, mientras recorre una distancia 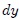 . Ahora bien, se puede expresar
. Ahora bien, se puede expresar 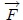 y el vector desplazamiento
y el vector desplazamiento 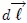 en función del vector unitario
en función del vector unitario 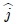 (perpendicular a la superficie del pistón). En efecto,
(perpendicular a la superficie del pistón). En efecto,
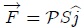
y además,
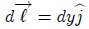
entonces,
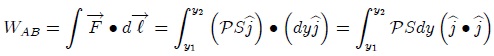
pero como,
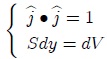
donde 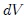 es el cambio diferencial del volumen del gas, resulta que el trabajo es dado finalmente por,
es el cambio diferencial del volumen del gas, resulta que el trabajo es dado finalmente por,
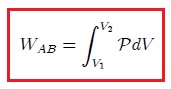
Este resultado es válido para el trabajo realizado en cualquier cambio de volumen siempre y cuando se efectúe en forma cuasiestática. Sin embargo, depende de la transformación que se realiza para ir desde el estado inicial al estado final, es decir, de la forma explícita de la función 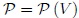 .
.
El trabajo 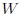 en (13) está considerado desde el punto de vista del sistema termodinámico, por lo tanto (como dije en EL CALOR, EL TRABAJO Y SU REALACION EN LA TERMODINAMICA): el trabajo es positivo cuando lo realiza el gas (expansión) y negativo cuando el exterior lo realiza contra el gas (compresión).
en (13) está considerado desde el punto de vista del sistema termodinámico, por lo tanto (como dije en EL CALOR, EL TRABAJO Y SU REALACION EN LA TERMODINAMICA): el trabajo es positivo cuando lo realiza el gas (expansión) y negativo cuando el exterior lo realiza contra el gas (compresión).

Public Domain - Fuente
Si graficamos, mis estimados amigos Hive-Lectores, la presión como una función del volumen, el cual es llamado Diagrama 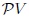 o Diagrama de Clapeyron (vean la figura 11), entonces la integral (13) representa el área total bajo la curva de presión entre el volumen
o Diagrama de Clapeyron (vean la figura 11), entonces la integral (13) representa el área total bajo la curva de presión entre el volumen 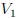 y el volumen
y el volumen 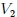 , como les muestro en la figura 12. Por lo tanto:
, como les muestro en la figura 12. Por lo tanto:
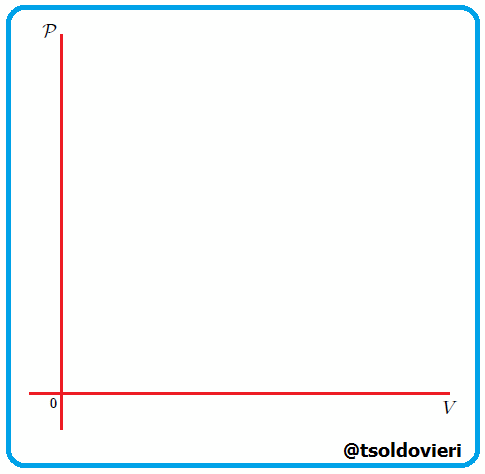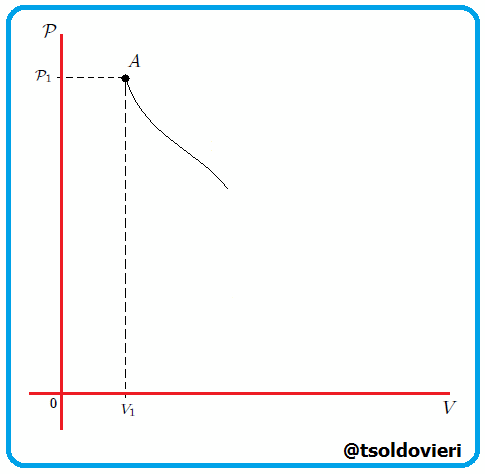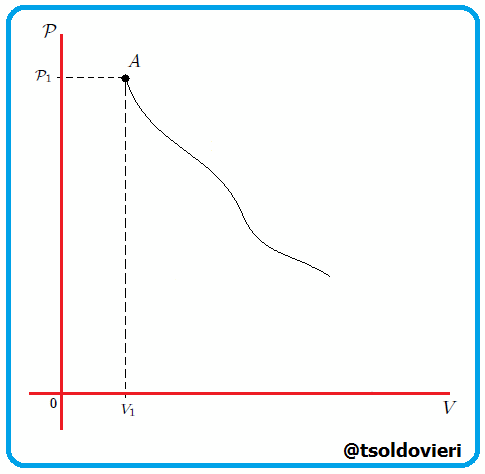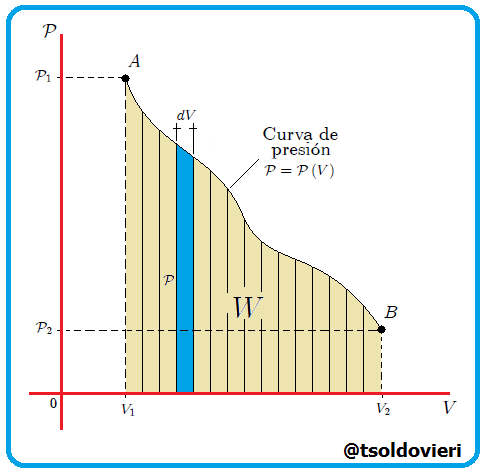
Gif animado realizado por mi persona, @tsoldovieri, usando las aplicaciones Paint y PhotoScape.
El trabajo realizado por un gas es siempre el área total bajo la curva de presión en un diagrama 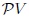 . . |
|---|
Mis amigos Hive-Lectores, el resultado anterior es independiente de las condiciones de la expansión. Si se hubiese permitido que la temperatura cambie, entonces la forma de la curva de presión habría sido diferente, pero el trabajo realizado por el gas seguiría siendo el área bajo la curva de presión.
Cuando un gas experimenta más de una transformación, el trabajo total es la suma del trabajo (con su signo) realizado por el gas en cada uno de ellos. |
|---|

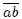 , con un
, con un 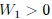 . La transformación 2 se da en
. La transformación 2 se da en 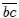 , con un
, con un 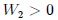 .
.Gif animado realizado por mi persona, @tsoldovieri, usando las aplicaciones Paint y PhotoScape.
En las figuras 13 y 14 les presento dos ejemplos donde ocurren lo antes dicho. En la figura 13 les muestro una transformación que le ocurre a un gas en dos etapas. La transformación 1 ocurre en el trayecto 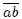 , realizándose un trabajo
, realizándose un trabajo 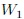 positivo. La transformación 2 ocurre en el trayecto
positivo. La transformación 2 ocurre en el trayecto 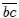 , realizándose un trabajo
, realizándose un trabajo 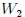 también positivo. Les muestro que el trabajo total
también positivo. Les muestro que el trabajo total 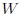 , que es positivo, viene dado por la suma de los trabajos de las transformaciones individuales.
, que es positivo, viene dado por la suma de los trabajos de las transformaciones individuales.

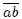 , con un
, con un 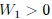 . La transformación 2 se da en
. La transformación 2 se da en 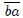 , con un
, con un 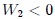 .
.Gif animado realizado por mi persona, @tsoldovieri, usando las aplicaciones Paint y PhotoScape.
En la figura 14, al igual que la figura 13, les muestro una transformación que le ocurre a un gas en dos etapas. La transformación 1 ocurre en el trayecto 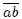 , realizándose un trabajo
, realizándose un trabajo 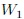 positivo. La transformación 2 ocurre en el trayecto
positivo. La transformación 2 ocurre en el trayecto 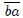 , realizándose un trabajo
, realizándose un trabajo 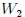 negativo y regresando al sistema a su estado inicial. Les muestro que el trabajo total
negativo y regresando al sistema a su estado inicial. Les muestro que el trabajo total 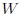 viene dado por la suma de los trabajos de las transformaciones individuales que, en efecto, se convierte en una resta debido al signo negativo de
viene dado por la suma de los trabajos de las transformaciones individuales que, en efecto, se convierte en una resta debido al signo negativo de 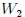 . El trabajo total
. El trabajo total 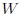 es positivo porque
es positivo porque 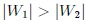 y, por lo tanto, realizado por el sistema y recibido por el exterior. Noten, mis estimados Hive-Lectores, que ambas transformaciones forman una trayectoria cerrada que es recorrida en el sentido del avance de las agujas de un reloj.
y, por lo tanto, realizado por el sistema y recibido por el exterior. Noten, mis estimados Hive-Lectores, que ambas transformaciones forman una trayectoria cerrada que es recorrida en el sentido del avance de las agujas de un reloj.
Si las transformaciones se hubiesen realizado en sentido contrario al que les muestro en la figura 14, entonces el trabajo 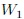 sería negativo y el trabajo
sería negativo y el trabajo 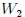 positivo, resultando negativo el trabajo total
positivo, resultando negativo el trabajo total 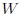 y, por lo tanto, realizado por el exterior y recibido por el sistema. Notemos que, en este caso, ambas transformaciones forman una trayectoria cerrada que es recorrida en el sentido contrario del avance de las agujas de un reloj.
y, por lo tanto, realizado por el exterior y recibido por el sistema. Notemos que, en este caso, ambas transformaciones forman una trayectoria cerrada que es recorrida en el sentido contrario del avance de las agujas de un reloj.
A la transformación termodinámica que les muestro en la figura 14 se le denomina Transformación Cíclica (ver CONCEPTOS FUNDAMENTALES DE LA TERMODINAMICA - PARTE 3).
Un Ciclo es una serie de transformaciones termodinámicas que llevan un sistema termodinámico de regreso a su estado inicial. |
|---|
El interés de este tipo de transformaciones radica en que todas las máquinas térmicas y las máquinas refrigeradoras, que serán abordadas más adelante, funcionan cíclicamente.

BIBLIOGRAFIA RECOMENDADA
Aquí les presento 7 textos que recomiendo si desean ahondar en el tema:
Soldovieri C., T. FISICA GENERAL - UNA INTRODUCCION A LOS FLUIDOS, VIBRACIONES Y TERMODINAMICA. Preprint, 2020. El borrador se puede descargar desde mi web http://www.tsoldovieritsweb.ihostfull.com
Bauer, W. & Westfall, G. D. FISICA PARA INGENIERIA Y CIENCIAS, volume 1. McGraw-Hill/Interamericana de México, S. A. de C. V., 2011.
Bueche, F. J. & Hecht, E. FISICA GENERAL. Schaum. McGraW-Hill / Interamericana Editores, S.A. de C.V., México, 10ma edition, 2007.
Fishbane, P. M.; Gasiorowicz, S. G. & Thornton, S. T. PHYSICS FOR SCIENTISTS AND ENGINEERS WITH MODERN PHYSICS. Pearson Education Inc., 3th edition, 2005.
Burbano de E., S.; Burbano G., E. & Gracia M., C. FISICA GENERAL. Editorial Tébar, S.L., 2003.
Halliday, D.; Resnick, R. & Krane, K. S. FISICA, volume 2. Compañía Editorial Continental, S.A. de C.V., México, 4ta edition, 1994.
Hewitt, P. G. CONCEPTOS DE FISICA. Editorial Limusa, México, 1era edition, 1992.


Estimados amigos Hive-Lectores. Espero que la anterior información les sea de mucha utilidad. Si tienen preguntas, no duden en hacérmelas llegar pues, con mucho gusto, les atenderé. Igualmente, si tienen detalles que puedan nutrir o mejorar la anterior información, por favor, háganmelas saber. Hasta la siguiente parte del presente post ¡Saludos a todos! 😁.
LES INVITO VISITAR MI WEB PERSONAL www.tsoldovieritsweb.ihostfull.com
En esta página web podrás conseguir los borradores de los libros de texto que estoy escribiendo y varias listas de problemas con respuestas de: Optica, Mecánica Clásica, Mecánica Cuántica, Física General 1, Física General 2 y Física General 3. También encontrarás enlaces a otras páginas web de interés.
Deja tus comentarios en el libro de visitas! 😁

Congratulations @tsoldovieri! You received a personal badge!
You can view your badges on your board And compare to others on the Ranking
Do not miss the last post from @hivebuzz:
Support the HiveBuzz project. Vote for our proposal!
Thanks @hivebuzz !
Saludos amigo @tsoldovieri, estoy en pleno proceso de aprendizaje con tus artículos, es un área muy compleja en la cual tienes amplios conocimientos, de nuevo excelente contenido, seguimos en comunicación !
Muchas gracias por tu visita y comentario amigo @amestyj. Saludos!
Gracias por la visita amigo @rbalzan79 y por tu excelente comentario. Es correcto lo que dices, las animaciones son de gran ayuda. Es correcto también el que se necesite mucho tiempo para hacerlas. Las del presente post estuve haciéndolas toda una tarde más la noche (hasta las 4 de la mañana). Todo sea por presentar algo que sea de utilidad real para todos. Un cordial saludo.
Thanks for your contribution to the STEMsocial community. Feel free to join us on discord to get to know the rest of us!
Please consider supporting our funding proposal, approving our witness (@stem.witness) or delegating to the @stemsocial account (for some ROI).
Please consider using the STEMsocial app
app and including @stemsocial as a beneficiary to get a stronger support.
!thanks @steemstem
Congratulations @tsoldovieri! You have completed the following achievement on the Hive blockchain and have been rewarded with new badge(s) :
You can view your badges on your board And compare to others on the Ranking
If you no longer want to receive notifications, reply to this comment with the word
STOPDo not miss the last post from @hivebuzz:
Support the HiveBuzz project. Vote for our proposal!
Thanks!
Otra entrega llena de la ciencia de los gases y imágenes animadas de gran calidad, gracias por compartir esta publicación. Saludos @tsoldovieri!
Muchas gracias amigos @acont. Un cordial saludo.