Estimados miembros de la comunicad de
#Steemit y muy especialmente
#Stem-espanol envió un caluroso saludo y agradecimiento por su apoyo al estudio y desarrollo de la ciencia. Hoy comparto con ustedes un estudio basado en metales de transición del grupo 11 de la tabla periódica. Los metales que constituyen este grupo son: Cobre (Cu), Plata (Ag) y Oro (Au), llamados en ocasiones metales preciosos debido a que se encuentran disponibles en la naturaleza en su forma pura sin necesidad de combinarse con otro elemento o compuesto, además son poco reactivos con otro elementos, la plata y el oro son usados en la joyería debido a que son los elementos más nobles (poseen gran resistencia a ataques de agentes corrosivos y ácidos).
 Cobre
Introducción
Cobre
Introducción
La tabla periódica ordena todos los elementos conocidos en función de sus propiedades y características en diversos grupos y periodos. En el grupo 11 de la tabla periódica se encuentran los metales de transición de la familia del cobre, conformado por: Cobre (Cu), Plata (Ag), Oro (Au). Estos metales poseen brillo metálico, particularmente el cobre presenta un color rojizo, blanco plateado la plata y el oro es de color amarillo, todos estos metales se presentan en estado sólido a temperatura, son blandos y maleables. Entre sus propiedades físicas destacan su alta conducción de calor y electricidad.
Estos metales se conocen desde la antigüedad como metales de acuñación por su uso para este fin. El cobre es uno de los metales más usados por el hombre históricamente, actualmente uno de sus usos más frecuentes lo constituya la fabricación de cables de alta tensión debido a que un metal muy dúctil. Por otro lado la plata al igual que el oro son metales conocidos mundialmente por su alto valor económico y son ampliamente usados en la fabricación de artículos decorativos. Químicamente estos elementos poseen en la capa exterior un solo electrón. Sus elementos se encuentran ampliamente distribuidos en la naturaleza en estado libre y como compuestos.
El cobre se halla en estado libre o en sulfuros, cloruros, arseniuros y carbonatos. Posee elevadas conductividades, en todas las proporciones es miscible con el oro, se oxida de manera superficial al aire, al calentarlo el este reacciona con el oxígeno para generar CuO y a temperatura superiores Cu2O. La plata es el elemento más conductor de la tabla periódica, químicamente es menos reactiva que el cobre, a excepción de su reacción con el sulfuro de hidrogeno, que ennegrece rápidamente la superficie de la plata. El oro es el metal con la mayor ductilidad y maleabilidad de todos los elementos conocidos. Su reactividad es muy baja no es atacado ni por el azufre y ni por el oxígeno, sin embargo reacciona con los halógenos y las soluciones que los generan.
 Elementos Cobre, Plata y Oro-Fuente: @rossyholg
Metodología
Elementos Cobre, Plata y Oro-Fuente: @rossyholg
Metodología
Reacción de Cu(s) con ácidos
Ácido nitricoHNO3 Ácido sulfúrico H2SO4 ácido clorhídrico HCl.
Se tomaron 3 tubos de ensayo en los cuales por separado se añadió una pequeña cantidad de los ácidos HNO3 H2SO4 y HCl, finalmente se agregó cada tubo un rozo pequeño de cobre metálico.
Reacción del Cu en la llama y con ácido clorhídrico HCl.
Una pequeña lámina de Cu metálico fue acercada a la llama de un mechero, luego de un período de tiempo expuesto a la llama, se introdujo la lámina de Cu a un tubo de ensayo que contenía HCl concentrado.
Halogenuros de plata.
Se tomaron 3 tubos de ensayos en los cuales se prepararon soluciones de nitrato de plata AgNO3 y luego se agregó a cada tubo, por separado sales de NaCl, KBr y KI, lo cual dio la formación a 3 precipitados, posteriormente se colocó un poco de cada uno de ellos en otros tres tubos de ensayos por separado. Con los productos integrados en cada tubo de ensayo, se añadió NH3 concentrado.
Obtención de la plata.
En un tubo de ensayo, se disolvió una cantidad del precipitado cloruro de plata AgCl en una solución de cianuro de potasio KCN y luego se introdujo trozos de zinc.
Resultados y Discusión
Reacción del cobre metálico con los ácidos.
Al introducir trozos de cobre metálico en H2SO4 y HCl no se observó reacción alguna, ni cambio de color en el metal o la solución, sin embargo al repetir el procedimiento con HNO3 se observó una reacción bastante rápida, el Cu exhibió efervescencia con el ácido nítrico, luego la solución comenzó a tornarse de color verde y a desprender un gas de color marrón, como se puede observar en la figura 1.
 Figura 1. Transcurso de la reacción Cu con HNO3-Fuente: @rossyholg
Figura 1. Transcurso de la reacción Cu con HNO3-Fuente: @rossyholg
La reacción entre el ácido nítrico y el cobre metálico ocurre de la siguiente manera:
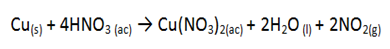
El cobre metálico se puede oxidar con ácido nítrico y este último se reduce a dióxido de nitrógeno según la reacción anterior. El NO2 es el gas marrón que se observó durante la experiencia.
La reacción entre el cobre y los ácidos sulfúrico y clorhídrico no procedió, debido a que estas reacciones deben ser espontaneas y según la energía libre de Gibbs es fácil ver que el HCl con el Cu es una reacción no espontanea, la energía libre de Gibbs de esta reacción es ∆Gºreaccion = 86 KJ/mol, un valor positivo representa una reacción no espontanea. Para el caso de la reacción entre el cobre y el ácido sulfúrico se muestra una ∆Gºreaccion = -56,7 KJ/mol. Como se puede evidenciar, esta reacción es de carácter espontanea debido a que tiene una ∆Gºreaccion negativo, sin embargo la cantidad es pequeña, motivo por el cual la reacción en frío no ocurre.
Reacción del Cu en la llama y con ácido clorhídrico HCl.
Al calentar la lámina de cobre directamente a la llama se observó una luz verde y la formación de una película sólida alrededor de color negro, esta película color negro formada es característica del óxido de cobre (II) debido que éste se forma calentando cobre en presencia de aire como lo muestra en la siguiente reacción:
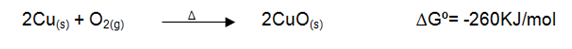
Asimismo, al agregar el cobre calcinado (II) al HCl, se pudo observar en la reacción un cambio de color en la solución a un color verde amarillento, lo cual se debe a que el óxido de cobre es un óxido básico, por lo tanto, se disuelve en ácidos minerales tales como el ácido clorhídrico para dar las correspondientes sales de cobre (II), tal como se muestra a continuación:
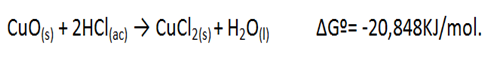
Halogenuros de plata.
Se observó, en cada reacción de AgNO3 con NaCl, KBr, y KI la formación de precipitados, donde el primero se obtuvo un color blanco, el segundo crema y el último amarillo, como se muestra en la figura 2.
 Figura 2. Precipitados formados al reaccionar AgNO3 con, KBr, KI y NaCl.Fuente: @rossyholg
Figura 2. Precipitados formados al reaccionar AgNO3 con, KBr, KI y NaCl.Fuente: @rossyholg
Cuando se agregó a cada uno de los precipitados una solución de NH3 en la campana de extracción, se solubilizó completamente el primer precipitado del AgNO3 con NaCl, para el segundo se observó muy ligera solubilidad y en el último caso no se disolvió el precipitado, como se muestra en la figura 3.
 Figura 3. Reacción de precipitados con ácido nítrico NH3.Fuente: @rossyholg
Figura 3. Reacción de precipitados con ácido nítrico NH3.Fuente: @rossyholg
En el análisis cualitativo, el ΔG° permite calificar la reacción formada como espontanea o no espontanea así como su Kps permite saber la capacidad de solubilidad que procede la sustancia, esto se puede apreciar para cada halogenuro en reacción con la plata como se muestra a continuación:

La reacción formada por Ag y Cl- es más espontánea que el resto de los haluros, debido a que su Kps es superior y un ΔG° mayor negativo, por lo tanto tiende a solubilizarse más rápido
El AgCl es menos iónico, es soluble sólo con la influencia del NH33. Se espera el aumento en la covalencia al pasar del fluoruro al yoduro, y que se observa una disminución en la solubilidad en agua, esto último se debe a que el anión es suficientemente grande y blando, que el catión estaría en condiciones de polarizarlo y, en situación extrema, el catión penetraría en la nuble electrónica de anión dando lugar a un enlace covalente.
Obtención de la plata.
Al reaccionar el precipitado AgCl con KCN, cambió su coloración a amarillo. La extracción del metal Ag implica el tratamiento con una disolución aireada de cianuro de sodio, proceso que extrae la plata como ion diciano argetato (I), [Ag(CN)2]-. La reacción formada es:
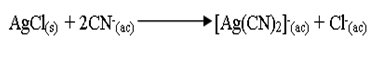
Asimismo cuando se le se agregó trozos Zn a la solución, se observó una película de aspecto blanco mate brillante, debido a que el metal se precipita de la disolución del cianuro complejo por medio del zinc metálico:
 Conclusiones
Conclusiones
Se apreció que los metales de este grupo, no se oxidan fácilmente en presencia de oxígeno, se necesita de energía térmica para lograr este proceso. Por otra parte se observó que las reacciones del Cobre frente al poder oxidante de los ácidos, difieren su espontaneidad en sus reacciones. Excepto con el ácido nítrico que se evidencia su gran poder oxidante.
Libros consultados
1Rayner Geoff; Canham, 2000, Química Inorgánica Descriptiva, 2da Edición, Ed. Prentice Hall, México, 489.
2Semishin V, 1967, Prácticas de química general inorgánica, Moscú, Ed. Mir, 193-196.
3Chang Rymond, 2007, Química, 9na edición, México, Ed. Mc Graw Hill, 796; 919; 246.
4Babor; Ibarz, 1958, Química General Moderna, 6ta edición, México, 691-710.
5WADE R. TONSON .Química orgánica, 2da edición, Mexico 156-157



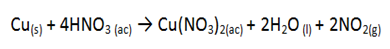
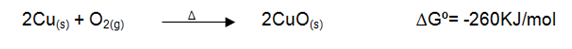
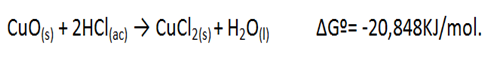





Buenas tardes @rossyholg gracias por compartir este material. Tengo una duda, las joyerías además de hacer un examen visual a las prendas de oro, también realizan pruebas con ácidos. Las prendas de Oro no dan reacción al agregar ácidos minerales como los que mencionas, ¿Por qué ocurre esto?
Holaaa gracias por el apoyo. En las joyerías para comprobar si el oro es puro o no se hace reaccionar con ácido nítrico, si no ocurre reacción entonces el oro es puro. El ácido nítrico tiene un alto poder oxidante y ataca a la mayoría de los metales, a excepción del oro, iridio y platino, tiene que ver por la espontaneidad de estas reacciones, su energia libre Gibbs indica que este tipo de reacciones no son espontaneas por lo tanto no proceden.
👏🏼👏🏼Hola @RossyHolg. He leído tu post. Ya veo la importancia de esto y también tengo la misma duda del compañero @wilmer14molina, por si nos lo puedes aclarar. Si estás en el servidor de Discord de la comunidad, te haré llegar aportes. Saludos.
Holaaaa gracias... A a orden para cualquier duda al respecto...
Congratulations @rossyholg! You have completed the following achievement on the Steem blockchain and have been rewarded with new badge(s) :
Click here to view your Board of Honor
If you no longer want to receive notifications, reply to this comment with the word
STOPDo not miss the last post from @steemitboard:
This post has been voted on by the SteemSTEM curation team and voting trail in collaboration with @curie.
If you appreciate the work we are doing then consider voting both projects for witness by selecting stem.witness and curie!
For additional information please join us on the SteemSTEM discord and to get to know the rest of the community!