Hola a todos

Fuente de la imagen: Propia
Introducción
La enseñanza de la ciencia es uno de los pilares fundamentales en cualquier sociedad. Por ello, son muchos los investigadores que se encargan de pulir las distintas estrategias que se pueden aplicar durante las clases. Cada una de las estrategias de enseñanzas, se debe saber implementar de formar idónea. Por ejemplo, tenemos las prácticas de laboratorio donde indiscutiblemente los estudiantes están procesando aspectos cognitivos que favorecen el ámbito científico, dentro de las cosas que promueve, tenemos un cambio en el lenguaje cotidiano a uno científico o científico escolar.
Por ello, como en la última ocasión, en colaboración con una materia que es de relevancia para la comprensión de la biología, presento una práctica que se emplea en la química de media general, el reconocimiento de pH en distintas soluciones. Esta experiencia fue aplicada por los estudiantes, a los cuales previamente fue dada una clase para el ámbito de la química y la biología.

Fuente de la imagen: Propia y editada en power point.
Una breve explicación teórica
Cuando hablamos sobre pH, estamos hablando de sustancias con niveles o rangos de acidez o basicidad. En los ambientes naturales, en el cuerpo humano, en productos que compramos para la limpieza hasta en las bebidas encontramos estos niveles. Por ejemplo, el jugo gástrico encontramos enzimas que tienen niveles pH ácidos que ayuda a digerir los alimentos que consumimos, además estas reacciones enzimáticas mantienen un pH óptimo permitiendo que la fisiología del cuerpo se mantenga en equilibrio. Una de estas enzimas en la Pepsina, que tiene un pH entre los intervalos de 2 a 3 considerado ácido, en este rango puede reaccionar o actuar, y para un pH mayor a 5 tiende a desactivarse.

Fuente de la imagen: Propia y editada en power point.
Por otra lado, un concepto de pH estricto para ser expresado cualitativamente, dice que el pH (poder del hidrógeno o potencial del hidrógeno) se define como el logaritmo negativo en base 10 de la concentración molar del ion hidronio o del ion hidrógeno, cuando se desea medir la acidez en soluciones acuosas y la concentración molar (mol/l) de los iones hidronio (H3O+).
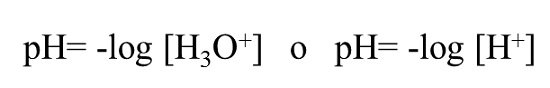
Fuente de la imagen: Propia y editada en power point.
Asimismo en la concentración de OH- ó ion hidroxilo, es expresado el pOH o también conocido como potencial de hidroxilo o poder hidroxilo. Este es definido como el logaritmo negativo en base 10 de la concentración molar de iones hidroxilos.
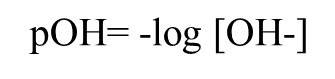
Fuente de la imagen: Propia y editada en power point.
Ahora bien, si aplicamos el término de pH relacionados a valores numéricos obtenidos en muestras es posible apreciar una escala en la cual vemos rangos para sustancias ácidas y básicas. Como vemos a continuación:

Fuente de la imagen: Propia y editada en power point.
La sumatoria de la escala de pH y pOH es 14:
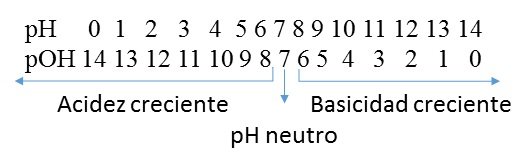
Fuente de la imagen: Propia y editada en power point.
En este sentido el valor constante no depende del grado de acidez o basicidad de la solución examinada a 25 grados centígrados, una solución ácida tiene valores de pH menores a 7, una solución básica o alcalina pH a mayor a 7 y una solución neutra presenta un pH igual a 7.
Enzimas como la ureasa que reacciona aproximadamente a pH 7, a en algunas plantas ayuda durante la obtención del nitrógeno. En nuestra saliva presentamos otras que normalmente tienen un pH entre los 6.6 a 7, y ayudan como primera fase para la degradación de alimentos. La tripsina, es una enzima que tambien participa en el proceso de disgestión y tienen un pH optimo aproximadamente en 8, esta misma es liberada por el páncreas. Con estos ejemplos podemos denotar, que podemos encontrar enzimas que reaccionan con determinados nivel de pH. Además es posible reconocer estos rangos en productos de uso cotidiano, en las concentraciones de aguas de manglar y demás; no solo en el cuerpo humano:

Fuente de la imagen: ararat.art
Momento de la práctica
En primer lugar un método de lectura directa que permite determinar el pH de soluciones acuosas, se fundamente en el uso de indicadores ácido-base. Un indicador es una sustancia que cambia de color cuando reacciona con un ácido o con una base. El color cambia por la adicción o remoción del ión hidrogeno (H+) a valores específicos de pH. Para la practica se utilizo el papel para medir el pH en las soluciones.
En este sentido, un indicado universal se obtiene al mezclar varios indicadores. Una mezcla puede contener fenolftaleína, rojo de metilo, azul de bromotimol, anaranjado de metilo. Este indicador universal es verde oscuro en soluciones neutras y cambia de rojo a violeta entre pH 3 y pH 10. Al impregnar el papel con un indicador universal, se obtiene el papel de prueba o pH común que puede ser de intervalo (1 a 12) o de intervalo estrecho (4,5 a 7,5).

Fuente de la imagen: Propia y editada en power point.
Para medir el pH utilizando el papel pH común se procede de la siguiente manera:
- En el tubo de ensayo o vaso precipitado que contiene la solución a examinar se introduce un agitador limpio y seco se humedece y se retira.
- Se impregna una pequeña muestra del papel pH y se compara el color obtenido, con la escala de colores existentes en el empaque del papel pH.
- Se anota el valor obtenido.
Para este caso la práctica fue trabajado con leche, café negro, refresco, agua jabonosa, vinagre, detergente y jugo de limón. En cada caso, las soluciones siguieron los pasos, primero fueron vertidos, después agitados con mucho cuidado, colocado el papel para comparar el color obtenido y saber aproximadamente el nivel de pH y por último anotar cada unos de los datos en una libreta de apuntes.

Fuente de la imagen: Propia y editada en power point.
Vale recordar, que este método es aplicado para pruebas consideradas como pruebas burdas y a pesar de ello es de igual importancia para el manejo en practicas de laboratorio. De igual manera, la exactitud de estos datos nunca debe pasar los niveles o unidades cuantitativas de pH. Con ello, vale decir que si se desea determinar la concentración de ión de hidronio en las muestras examinadas, es posible utilizar la siguiente fórmula::

Fuente de la imagen: Propia y editada en power point.
Esta misma fue aplicada para la determinación de las sustancias utilizadas en la practica, las cuales son de uso cotidiano. A continuación se muestra la tabla con los resultados:
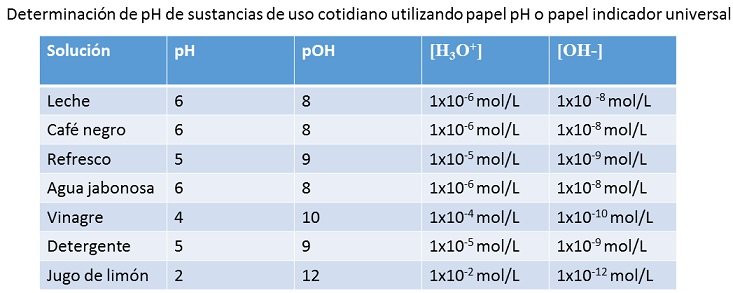
Fuente de la imagen: Propia y editada en power point.
Reflexión
Las practicas de laboratorio son sumamente importante para la enseñanza de las ciencias, estas son vistas como estrategias o actividad medular para el desarrollo cognitivo de los estudiantes. Además, desde el punto de vista empírico, los estudiantes aprenden las normas y el procedimiento que se deben de seguir para poder establecerse en sus futuras carreras universitarias. A la par, las actividades académicas en conjunto con materias afines, en la cual cada una aporte un contenido similar, se debe considerar como herramientas para que los estudiantes comprendan que la ciencia trabaja en conjunto para comprender más acerca de la naturaleza.
Referencia de la información
- H. Curtis. Biología general
- Trujillo. Soluciones acuosas: teoría y aplicaciones. Módulo de apoyo académico en Química
- Aportes para la enseñanza para el nivel medio. Consultado 2018
Es una manera sencilla y fácil de aprender de un parámetro importante en la Química, te felicito.
Gracias por tu comentario, ciertamente tiene una relevancia en la Química y en la biología. :)
Holaa!! Este post esta bueisimo, lo ddigo porque estudie la carrera hasta el 6to semestre y este tipo de post informativos/educativos de quimica me llenan el alma; esta bien estructurado y tiene una informacion rica en contenido asi como buen uso de imagenes.
pero...
Si, hay un pero.
A la hora de usar imagenes de banco de imagenes, te recomiendo tratar de que no aparezca la marca de agua y si ni al caso, pues optar por otra, es un poco incomodo a la vista y le quita belleza y pulcritud al post -a pesar de que se pona al fuente-.
La verdad, felicidades. Abrazos.
Muchas gracias por tu aporte y el consejo. Feliz día.
Este post me pareció una joya informativa ¡Gracias por tomarte el tiempo de crearlo!
En el liceo no le presté mucha atención a la química, y ahora, varios años después, hallé en ella un gusto especial.
Estuve viendo tu blog, y los otros trabajos que has publicado también son geniales, aunque sería super que postearas con más frecuencias; publicaciones como las tuyas le dan valor a Steemit 😄
Haré lo posible para publicar con más frecuencia. Gracias y me alegro que el contenido sea disfrutado por otros. Feliz día.
Hola muy importante y útil este tipo de post. Lamentablemente no esta fácil conseguir el papel indicador de pH. Saludos.
Gracias por tu comentario. Cierto es un poco complicado. Feliz día.
Muy buena lección! Muchas gracias por compartir. 🙏🏼
Gracias, siempre es agradable esas opiniones.
Es información muy útil :)
Me toco aprender a llevar el ph de ciertos productos de consumo, a neutro para que las repercusiones en la piel sean minimas y la verdad es que no tenia idea de esto. Asi que me toco investigar para finalmente alcanzarlo
Son cosas que aprenden entre lo teórico y lo practico :). Feliz día.