Saludos estimada comunidad de steemit y #stem-espanol.
Pero en la industria química los nitruros de los metales de transición han recibido especial atención por contarse como los posibles sustitutos de los catalizadores a base de metales nobles, ¿la razón? estos han demostrado tener capacidad para catalizar diversas reacciones, entre las que destacan las reacciones de isomerización, hidrogenación, deshidrogenación, oxidación, entre otras, con rendimientos muy comparables con los catalizadores tradicionales y una ventaja importante, resultan más económicos que el platino o el paladio por ejemplo.
La atención que han recibido las propiedades catalíticas de estos materiales se debe principalmente a la presencia del átomo de nitrógeno en la red cristalina que forma el material; dada la diferencia de electronegatividad entre este átomo y el metal, se crean en el nitruro sitios con propiedades tanto ácidas como básicas, que les confieren propiedades catalíticas semejantes a la de los metales nobles1,2.
Pero, ¿que son los nitruros de metales de transición?
Fuente: Composición elaborada por el autor.
Estos son materiales constituidos de una fase intersticial que resulta por la incorporación de nitrógeno en la red cristalina del metal, lo que les confiere características de sólidos cristalinos y covalentes. Poseen características semejantes a las cerámicas refractarias, como altos puntos de fusión, gran dureza y resistencia, pero al mismo tiempo exhiben propiedades como la conductividad eléctrica de los metales.
Entre las propiedades de los nitruros se sobresale su gran dureza, refractaridad y resistencia a la corrosión; lo que les ha conferido una de sus aplicaciones más conocidas, su uso como recubrimiento del filo de las herramientas de corte. Pero su uso no se ha limitado a una herramienta, también despertaron el interés como catalizadores. Muchos estudios se han realizado sobre su uso catalizando reacciones de hidrogenación, síntesis de amoniaco, hidrogenación y deshidronitrogenación3.
• Propiedades estructurales
Los nitruros de metales de transición se caracterizan por poseer una estructura cristalina simple. Los átomos del metal pueden formar redes cristalinas con estructura cúbica centrada en las caras (fcc), hexagonal simple (hex). Los átomos de nitrógeno se colocan en los sitios intersticiales entre los átomos del metal. En general, los átomos de nitrógeno ocupan los sitios intersticiales más grandes disponibles, es decir, los sitios octaédricos de las estructuras fcc y los sitios de pirámide trigonal en la hexagonal5.
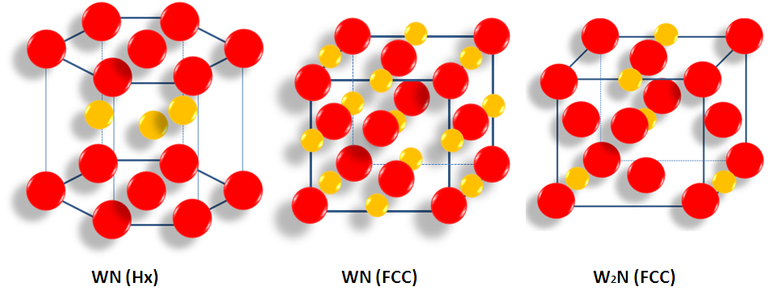
Fuente: imagen elaborada por el autor.
• Propiedades electrónicas
Estudios teóricos de los nitruros de metales de transición indican que los enlaces de estos compuestos son de carácter metálico, covalente e iónico simultáneamente. La contribución metálica está relacionada con la estructura de los enlaces metal-metal; la contribución covalente es debida a la formación de enlaces covalentes entre el metal y los átomos del no metal; y la contribución iónica se caracteriza por el traslado de carga entre el metal y los átomos del no metal. En general, los aspectos más importantes de la propiedades electrónicas están relacionadas con la dirección y cantidad de transferencia de carga y el efecto de la modificación en el orbital d del metal en la formación del nitruro.
• Propiedades catalíticas
Uno de los principales intereses en la aplicación de nitruros como catalizadores es para ser usados como una alternativa más económica frente los metales nobles del grupo 8. En muchos casos la actividad catalítica de los nitruros reemplaza a los metales nobles, por ejemplo, para hidrogenación e hidrogenólisis los nitruros han demostrado actividades catalíticas que son similares.
En los nitruros se modifica la naturaleza del orbital -d de los átomos metálicos, dando lugar a propiedades catalíticas diferentes a la del metal puro, pero que son similares a las mostradas por los metales nobles del grupo 86.

Síntesis de nitruros
Tradicionalmente los nitruros de metales de transición se han obtenido mediante reacciones sólido–sólido, preparación conocida como método cerámico o metalúrgico, haciendo mezclas mecánicas de los elementos o de los óxidos metálicos en atmósferas nitrantes, las cuales se calientan a altas temperaturas (mayor a 1500 ºC) por tiempos prolongados de reacción, consiguiendo fases únicas muy puras, sin embrago con baja área superficial.
Esta desventaja, además de que otras técnicas requieren mayor equipamiento, fueron la razón que promovió el uso de otros métodos para sintetizarlos, siendo el método de reacción a temperatura programada el más utilizado, dado que permite obtener fases puras en atmósferas nitrantes con mejores áreas superficiales.
Reacción a temperatura programada
El método consiste en partir de un precursor oxido y someterlo a una nitración reductora aumentando la temperatura de manera uniforme y luego enfriar el producto progresivamente en atmósfera inerte. La síntesis involucra la transformación directa de un óxido a nitruro. Este método ha sido ampliamente estudiado por el grupo de Boudart y colaboradores7 para la síntesis de nitruro de molibdeno partiendo del MoO3 como sólido precursor, en otros estudios8 se ha utilizado el WO3 como precursor para la síntesis del nitruro de tungsteno (W2N); para ambos precursores se utilizan temperaturas de síntesis de 700 ºC, con rampas variables de incrementos, bajo una atmósfera nitrante suministrada por un flujo constante de amoniaco (NH3), por cual en ocasiones se hace referencia al método como Nitración a Temperatura Programada (TPN).
El nuevo precursor
Cuando se utilizan óxidos como precursor en el método antes descrito se requieren elevadas temperaturas de síntesis, lo mismo ha pasado cuando se han utilizados sales de amonio de Mo o W. Sin embargo, el análisis termogravimetrico realizado al ácido tungstofosfórico, presentado en el post anterior (pueden leerlo aquí) reveló que bajo una atmósfera reductora este se descomponía en WO3 a una temperatura de aproximadamente 500 ºC, con lo cual surgió el interés de utilizarlo como precursor para el nitruro de tungsteno.
El método
Para ello se coloco una muestra del ácido tungstofosfórico en un reactor de cuarzo, y disponiendo éste en un horno tubular con control de temperatura, se procedió a su reducción bajo una atmosfera nitrante de amoniaco, aumentando la temperatura rápidamente hasta los 350 ºC para luego reducir la rampa de calentamiento a 1 ºC/minuto hasta alcanzar los 500 ºC, condición que se mantuvo por espacio de 120 minutos; al cabo de este periodo reemplazo el amoniaco por argón para enfriar el producto en una atmósfera inerte.
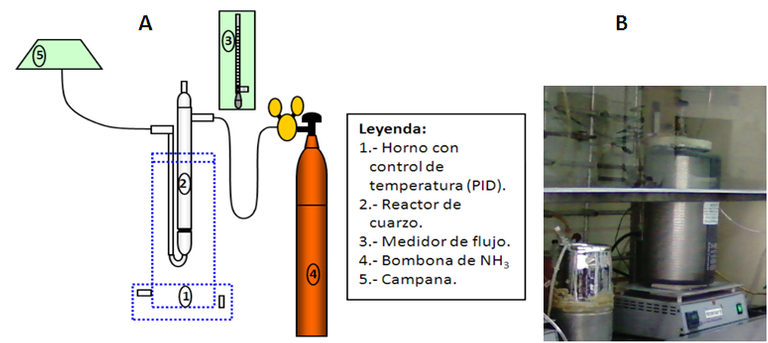
Fuente: imagen elaborada por el autor
Los resultados
Para determinar la fase cristalina presente en el sólido luego de la nitración, muestras del mismo se analizaron en un difractómetro SIEMENS 5005D.
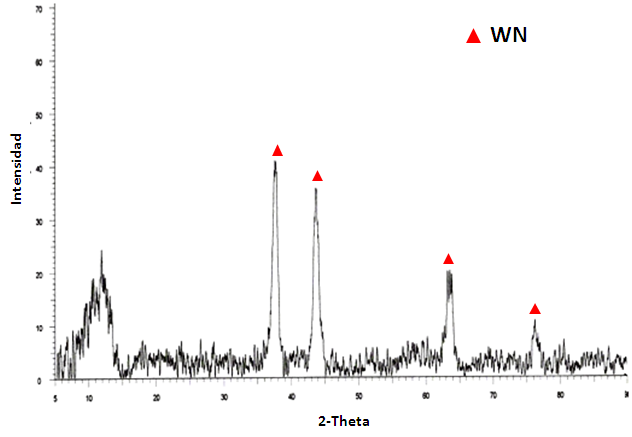
Fuente: propia
En la figura anterior se muestra el patrón de difracción de rayos X (DRX) del sólido nitrado. En el mismo se observó que las señales de mayor intensidad a 37,6º, 44º, 63,8º y 76º corresponden a la fase β-W2N que ha sido reportada en la literatura2, con características de una estructura hexagonal según lo dicado en la base de datos del centro internacional de datos de difracción (tarjeta PDF-772004).
Lo que demostró que las condiciones de síntesis a partir del precursor seleccionado permitieron obtener una fase pura de nitruro de tungsteno bajo condiciones de temperatura menos elevadas que las reportadas partiendo de un óxido o la sal del mismo metal.

Saludos @emiliomoron

Referencias:
- McGee, R.; Bej, S.; Thompson, L.; (2005). Basic properties of molybdenum and tungsten nitride catalysts. Aplied catalysis A: General. 284, 139-146.
- Shi, C.; Yang, X.F,; Zhu, A.M.; Au, C.; (2004). Catalityc activities of tungsten nitride for NO dissociation and reduction with hydrogen. Catalysis today, 93-95; 819-826.
- OYAMA, S. (1992). Preparation and catalytict properties of transition metal carbides and nitrides. Catalysis Today. 15, 179-200.
- Restrepo, E.; Arango, P.; Casanova, S.; (2009). Algunos conceptos sobre nitruro de titanio y carburo de titanio. DYNA, Volumen 76, Número 157, p. 213-224. Disponible en: https://revistas.unal.edu.co/index.php/dyna/article/view/9570/11497.
- Cotton; W.; (1996). Advanced Inorganic Chemistry. Tercera edición. New York.
Fuente de las imagenes de la composición con licencia CC0: refineria, herramientas
Muchas gracias por el apoyo Breili!
Muy buen tema mi querido amigo @emiliomoron, me ha gustado eso de las imágenes realizadas por ti mismo. Saludos
Saludos amiga @maurelvys. Muchas gracias por apreciarlo y dejar tu comentario!
Hi @emiliomoron!
Your post was upvoted by utopian.io in cooperation with steemstem - supporting knowledge, innovation and technological advancement on the Steem Blockchain.
Contribute to Open Source with utopian.io
Learn how to contribute on our website and join the new open source economy.
Want to chat? Join the Utopian Community on Discord https://discord.gg/h52nFrV
Thank you so much @utopian-io for the supporting!
Tu trabajo es de extrema calidad te felicito.
Buenísimo estimado Emilio, que genial que nos presentes avances en la tecnología actual aplicada en química.
Gracias amigo @migueldavidor, ese es el proposito, poder compartir en este medio los avances que se han hecho en este campo. Saludos!