Anteriormente en El Acero y el hidrógeno (Parte I), hablamos sobre las fuentes de ingreso del hidrógeno en el acero durante su fabricación y procesos de conformación y el papel que juega este elemento en el comportamiento de los productos fabricados con esta aleación. En esta oportunidad haremos referencia a aquellos factores que influyen directamente en la solubilidad del hidrogeno en el acero, las consecuencias de su presencia en los productos terminados fuera de los límites aceptables y las medidas de precaución a considerar para evitar los daños asociados a este elemento.
.gif)
.gif)
La solubilidad del Hidrógeno en el acero depende básicamente de tres factores:
- La Estructura Cristalina,
- La Temperatura y
- La Composición Química.
Algunos metales como el hierro (Fe), suelen cristalizar en distintas formas según la temperatura. Este fenómeno se denomina Polimorfismo.
En el caso del hierro, cuando la temperatura es inferior a 910°C y superior a 1400°C, su estructura cristalina es Cúbica Centrada en el Cuerpo (c.c), la cual se caracteriza porque sus átomos se ubican en los vértices y centro del cubo, a estas fases se les denominan Hierro Alfa y Hierro Delta respectivamente y la solución sólida con Carbono en cada una de ellas llamada Ferrita puede contener hasta un máximo de Carbono de 0.025% y 0.10% respectivamente.
Cuando el hierro esta entre 910°C y 1400°C, su estructura es Cúbica Centrada en las Caras (c.c.c) , denominada así porque sus átomos se ubican en el centro de cada una de las caras y en los vértices del cubo, a esta fase se le llama Hierro Gamma y su solución sólida con carbono se denomina Austenita que acepta hasta un máximo de 2%C.
.gif)
Cambio de estructura cristalina en el hierro en función de la temperatura
Dada la configuración de la estructura cristalina de la Austenita (cubica centrada en las caras) esta permite una mayor solubilidad del hidrogeno que la estructura Ferrítica, es por ello que entre 910 y 1400°C el acero es más susceptible al ingreso del hidrogeno como soluto.
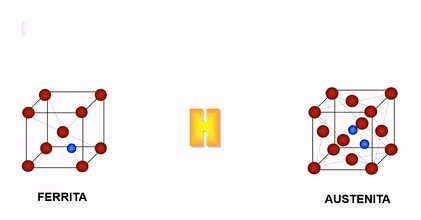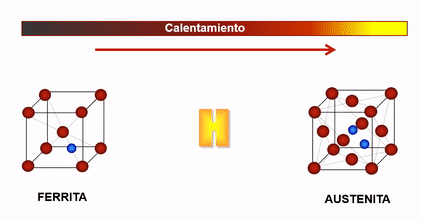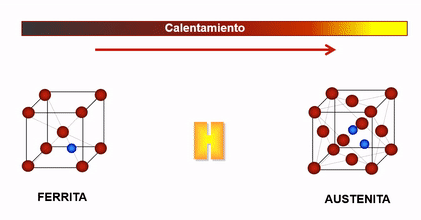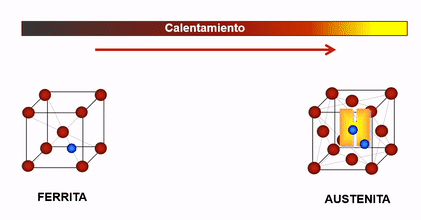.gif)
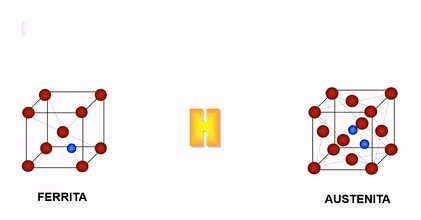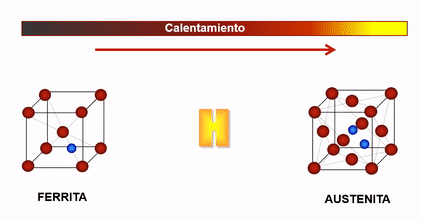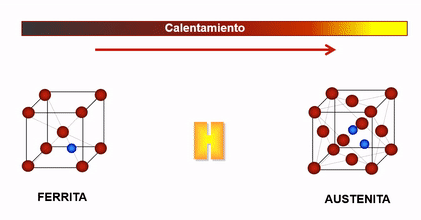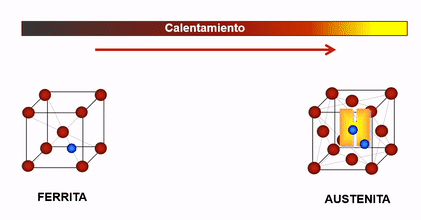.gif)
Afinidad del hidrógeno según la estructura cristalina
Las unidades de medida generalmente utilizadas para expresar las cantidades de hidrógeno son las partes por millón (ppm) y milímetros o centímetros cúbicos de hidrógeno, a temperatura estándar y presión por 100 g de acero. La relación entre los dos es 1ppm = 1.11 ml/100g.
En todos los casos la solubilidad del hidrógeno en el acero incrementa con la temperatura, llegando a presentar incrementos desde 1 ppm a temperatura ambiente hasta 8 ppm a 704°C.
Otro de los factores clave en el grado de solubilidad del hidrógeno en el acero, es la composición química. Cada elemento ejerce un papel especifico es esta reacción. Por ejemplo:
El Carbono (C) generalmente incrementa la solubilidad del hidrógeno.
El Manganeso (Mn) tiene un efecto complejo, el cual depende de la estructura cristalina.
El Silicio (Si), el Tungsteno (W) y el Aluminio (Al) reducen la solubilidad del hidrógeno.
El Cromo (Cr) hasta un 10% incrementa la solubilidad del hidrógeno, pero concentraciones más altas la disminuyen. El efecto se explica en términos de la estructura cristalina ya que cerca del 10% de Cr se cierra el bucle de la austenita y a concentraciones más altas causa que el acero sea totalmente ferrítico hasta el punto de ebullición.
El Níquel (Ni) incrementa la solubilidad del hidrógeno, siendo esta proporcional a su contenido.
Y hay elementos como el Molibdeno (Mo) que no tiene efecto sobre la solubilidad.
Otros elementos como el Vanadio (V), Titanio (Ti), Niobio (Nb), Circonio (Zr) y Tantalio (Ta) incrementan la solubilidad del hidrógeno particularmente a temperaturas bajas o moderadas.
El trabajo en frío no tiene efecto sobre la solubilidad del hidrógeno en aceros puros, pero la presencia de carburos causa un marcado incremento de la misma. Se cree que el hidrógeno migra y se confina en espacios internos formados cerca de los carburos o partículas de inclusión. Entonces cuando algunos aceros trabajados en frío son recocidos el hidrógeno se remueve por difusión. div>
Efecto
El hidrógeno es considerado un elemento perjudicial para el acero, sobre todo en aquellos de alta resistencia utilizados bajo condiciones de servicio de alta exigencia, por lo que es prioritario en estos casos tomar las medidas para removerlo y añadir los elementos aleantes necesarios que permitan protegerlos de la acción de esta impureza.
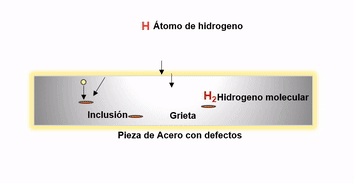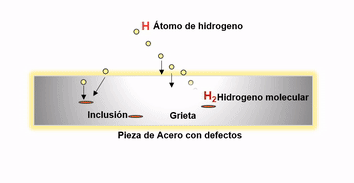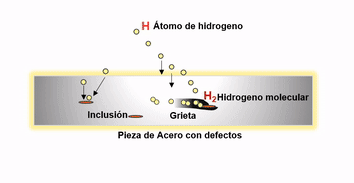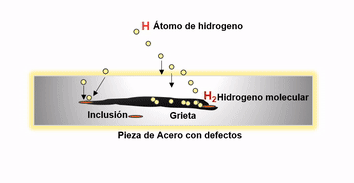
Después de la fabricación del acero el hidrogeno remanente migra a los defectos internos donde se recombina para formar hidrógeno gaseoso H2. La presión ejercida por el hidrógeno precipitado puede ser sustancial, pudiendo ser el causante de fallas catastróficas en productos tales como grandes cigüeñales y rotores de turbinas.
.gif)
Agrietamiento por difusión de hidrógeno
El hidrógeno que ingresa al acero sólido también puede confinarse en espacios vacíos. Como la presión aumenta en estos espacios se presentan ampollas de hidrógeno. Los aceros al cromo molibdeno, son resistentes a esta forma de ataque y son por lo tanto ampliamente utilizados donde el peligro potencial de hidrógeno puede existir.
El hidrógeno intersticialmente disuelto es también muy peligroso, ya que causa un incremento en el esfuerzo de fluencia y disminuye la ductilidad y propiedades de impacto. Esta es una forma de agrietamiento por hidrógeno conocida como Falla Retrasada o Fatiga stática, la cual ocurre en aceros de alta resistencia que han sido cargados con hidrógeno catódicamente o de otra manera y que son sometidos a cargas de tensión por debajo del esfuerzo de fluencia. Después de un periodo el cual puede extenderse de minutos a varias semanas, dependiendo del contenido de hidrógeno, la temperatura y el nivel de esfuerzo, la falla del acero es completamente frágil.
Finalmente el hidrógeno es conocido por causar agrietamiento en las soldaduras, principalmente en aceros de alta resistencia que exceden el esfuerzo de tensión 1690 Mpa. Este mecanismo está relacionado a la falla retrasada descrita arriba y es prevenido a través del uso de electrodos de bajo hidrógeno o tratamientos térmicos post soldaduras
¿Cómo prevenir el efecto negativo del Hidrógeno en el acero?
El contenido de hidrógeno en el acero líquido puede ser minimizado asegurando que toda la carga de materiales, horno, adiciones en el cucharon y refractarios estén totalmente secos. Sin embargo, otras fuentes de ingreso como el hidrogeno contenido en los gases del horno y la humedad atmosférica, son más difícil de evitar.
Existen técnicas que han sido desarrolladas para remover el hidrógeno del acero líquido. Estas incluyen el burbujeo de argón, adición de PTFE (Polytetrafluoroethylene) y limpiadores propietarios, el AOD (Argon Oxygen decarburization), y la desgasificación al vacío. Las últimas dos son las más efectivas y ampliamente usadas en la actualidad. En todos los casos, el principal objetivo es reducir el contenido de hidrógeno disuelto por debajo del límite de riesgo hasta ubicarse alrededor de 2.5 ml / 100g.
El hidrógeno que ingresa durante la desoxidación puede ser reducido a través del uso de inhibidores.
El hidrógeno puede ser removido del acero sólido por cocción o recocido. La rata de remoción depende de la temperatura y del área o diámetro de la parte que está siendo tratada. La remoción de hidrógeno es aproximadamente 250-400 veces más rápida a 205°C que a temperatura ambiente, pero la temperatura de recocido puede no ser tan alta como el incremento de la solubilidad del hidrógeno con la temperatura.
Introducción a la metalurgia. Pedro H Álvarez. Unexpo Vicerrectorado Pto Ordaz. 1996
Ferroalloys and alloging additive handbook. Paul D. Deeley; Konrad J.A Kundig and Howard R. Spendelow, Jr. 1981
Es clave para disminuir el efecto negativo del hidrogeno en el acero, promover las condiciones óptimas durante la aceración para evitar en lo posible la presencia de inclusiones o defectos internos después de la solidificación. Ya que la existencia de este tipo de discontinuidades favorecen la migración de este elemento hacia las mismas, aumentando el riesgo de agrietamientos inminentes en productos en pleno uso. Esto se logra utilizando durante el proceso de aceración prácticas adecuadas de limpieza y control de morfología inclusionaria y controlando adecuadamente los parámetros operativos que permitan reducir al máximo los defectos.
Espero les haya sido de utilidad este post. Espero verlos en el próximo, en el cual estaremos hablando de otro elemento.
Referencia Bibliográfica
Introducción a la metalurgia. Pedro H Álvarez. Unexpo Vicerrectorado Pto Ordaz. 1996
Ferroalloys and alloging additive handbook. Paul D. Deeley; Konrad J.A Kundig and Howard R. Spendelow, Jr. 1981

Hola excelente publicación, son temas de gran contenido teórico que tienen muchas aplicaciones importantes, realmente no sabía del efecto perjudicial del hidrógeno en el acero haciendo que pierda ductilidad. Saludos!
Hola. Que bien que te gustó. Precisamente cada elemento químico juega un papel muy importante en las aleaciones. Y de la concentración y estado de estos en solución depende el desempeño y propiedades de los productos. Estaré publicando post sencillos y gráficos sobre la influencia de los elementos en el acero. saludos
This post has been voted on by the SteemSTEM curation team and voting trail. It is elligible for support from @curie.
If you appreciate the work we are doing, then consider supporting our witness stem.witness. Additional witness support to the curie witness would be appreciated as well.
For additional information please join us on the SteemSTEM discord and to get to know the rest of the community!
Please consider setting @steemstem as a beneficiary to your post to get a stronger support.
Please consider using the steemstem.io app to get a stronger support.