Pour ce premier article, j'ai donc décidé de vous parler des atomes et des molécules !
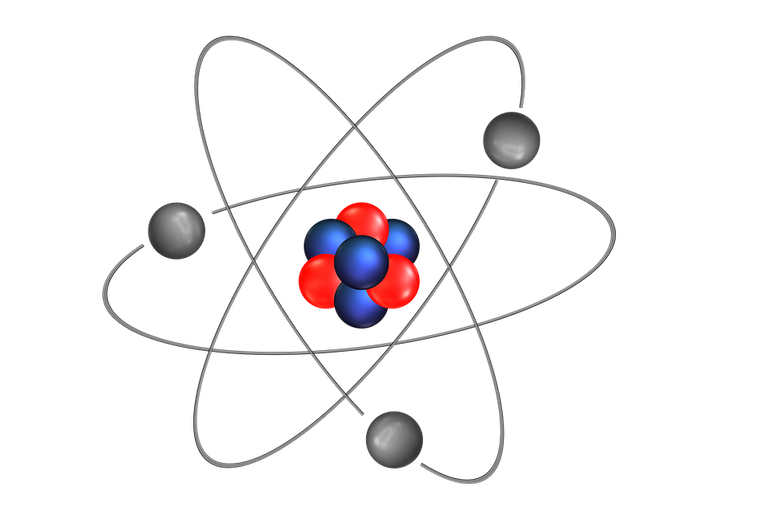
Les particules subatomiques des atomes
Les atomes sont constitués de trois types de particules subatomiques : les protons, les neutrons et les électrons.
Chaque atome est caractérisé par son numéro atomique Z, qui représente le nombre de proton de son noyau. Chaque atome a son propre numéro atomique : 1 pour l'hydrogène, 2 pour le lithium, 6 pour le carbone ou encore 8 pour l'oxygène. Les atomes possèdent également un nombre de masse, noté A. On note N le nombre de neutrons.
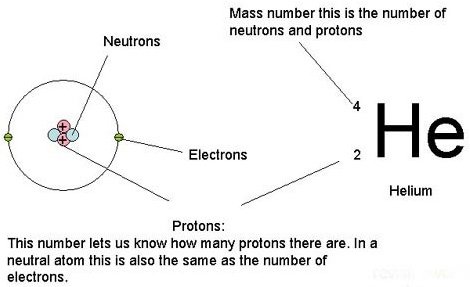
Si le proton et le neutron ont des masses quasi-équivalente, l'électron est quant à lui beaucoup plus léger.
- m(p) = 1,672 × 10-27 kg
- m(n) = 1,675 x 10-27 kg
- m(e-) = 9,109 × 10−31 kg
Pour exprimer la masse d'un atome ou d'une particule subatomique, on peut utiliser l'unité de masse atomique, notée "u". Cette unité correspond à 1/12ème de la masse d'un atome de carbone 12 contenant 6 protons et 6 neutrons.
Les charges
Ces particules n'ont pas seulement une masse, elles ont aussi une charge. Les protons sont chargés positivement et les électrons négativement. Quant aux neutrons, ils ont une charge neutre (nulle) comme leur nom l'indique.
Les charges sont exprimées en coulombs (C). Un coulomb correspond à la quantité d'électricité qui traverse un conducteur pendant une seconde avec une intensité d'un ampère. Un coulomb s'écrime donc en A.s.
- Charge d'un proton (+e) : +1,602 176 565×10-19 C.
- Charge d'un électron (-e) : -1,602 176 565×10-19 C.
- Charge d'un neutron : 0 C.
Les isotopes
Plusieurs atomes d'un même élément peuvent avoir le même numéro atomique (c'est-à-dire le même nombre de protons), mais pas forcément le même nombre de neutrons. Quand des atomes ont le même numéro atomique, mais pas le même nombre de neutrons, on dit que ce sont des isotopes.
Par exemple, l'hydrogène a "normalement" un nombre de masse égal à 1, mais il existe des isotopes comme le deutérium (où A = 2) et le tritium (où A = 3).
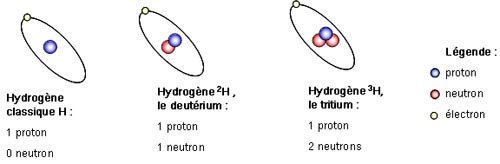
L'uranium est bien connu pour avoir plusieurs isotopes. D'ailleurs, si on vous dit "isotopes", vous allez probablement penser directement à "radioactivité" ou à "nucléaire".

Comme deux isotopes n'ont pas le même nombre de neutrons, ils ont donc une masse différente.
Les ions
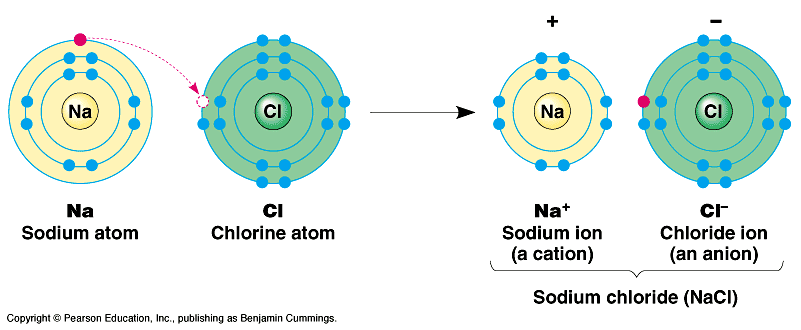
Dans un atome neutre, le nombre d'électrons est égal à celui du nombre de protons. Cependant, dans certaines conditions, les atomes peuvent gagner ou perdre un ou plusieurs électrons. Ils deviennent alors des particules chargées appelées ions.
Par exemple, le lithium (Li) peut perdre un électron et se transformer en ion Li+. Un atome comme le fluor (F) peut gagner un électron pour se transformer en ion fluor (F-).
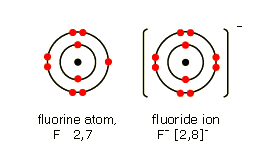
Les ions chargés positivement sont appelés cations et les ions chargés négativement sont appelés anions.
Les liaisons chimiques et les molécules
Les atomes peuvent former des assemblages nommés molécules. Une molécule est formée d'au moins deux atomes liés par une ou plusieurs liaisons chimiques. Qu'est-ce qu'une liaison chimique ? Pour simplifier, c'est une liaison formée par des électrons situés sur la couche externe des atomes.
Il existe plusieurs types de liaisons. Voici les principales d'entre elles.
- Les liaisons ioniques (entre métaux et non-métaux). Une liaison ionique correspond au transfert d'un électron d'un atome à l'autre. Par exemple, on peut citer le cas de la liaison entre Na+ (ion sodium) et Cl- (ion chlorure).
- Les liaisons covalentes (entre des non-métaux). Elles résultent de la délocalisation d'électrons de valence.
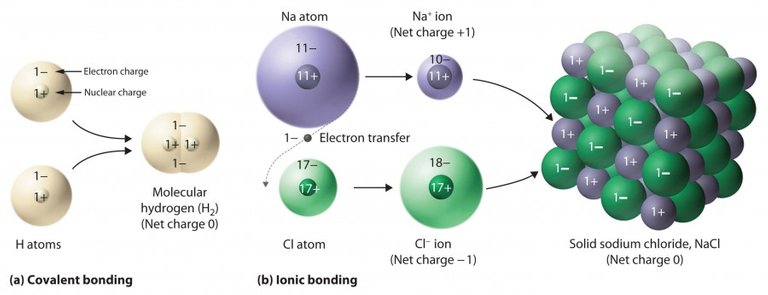
- Les liaisons métalliques (entre plusieurs métaux).
Ceci est mon premier article sur le thème de la physique et de la chimie. Si vous avez des suggestions d'améliorations ou de corrections à apporter, vous pouvez me contacter via le Discord de FrancoSteemVotes ou sur steemit.chat.
Sources
- http://www.irsn.fr/FR/connaissances/Nucleaire_et_societe/education-radioprotection/bases_radioactivite/Pages/3-isotope.aspx#.WmolcslLFhE
- https://www.futura-sciences.com/sciences/definitions/chimie-molecule-783/
- https://www.futura-sciences.com/sciences/definitions/physique-coulomb-335/
https://chem.libretexts.org/Textbook_Maps/General_Chemistry_Textbook_Maps/Map%3A_Chemistry%3A_The_Central_Science_(Brown_et_al.)/02._Atoms%2C_Molecules%2C_and_Ions/2.7%3A_Ions_and_Ionic_Compounds
https://en.wikipedia.org/wiki/Atomic_number
http://res-nlp.univ-lemans.fr/NLP_C_M13_G03/co/grain4-2-0.html - "Principes de Chimie : une approche moléculaire", Nivaldo J.Tro.
Excellent ton article @lefactuoscope ! Par contre le # c'est #francostem et non pas #francosteem :-) !!
C'est corrigé.
Merci Amélie pour cette précision !! :) Rien ne t'échappe on dirait ;) lol
Good post carry on dear
Pour une première c'est assez réussi ! Upvoté à 100% !
Hé bien, avant toute chose, je tien a préciser que je suis chimiste de formation et ton article ma vraiment bien plus !
Je connaissais pratiquement tout (logique) mais cela fait toujours plaisir de revoir les bases et de re-penser à des choses oublié.
Merci
Comme un autre commentaire je suis chimiste de formation, donc pas de grande révolution ici mais des bases intéressantes à partager ^^
C'est une des beautés de Steemit :-)
Super article ! Comme dit précédemment, ça fait plaisir de redécouvrir des choses oubliées.
Bon article :) Merci à toi...
J'aurais vraiment aimé avoir ton article durant le lycée, il m'aurait évité un bon nombre de prise de tête ! Les explications sont simple et les schémas sont top. bravo.
Ca fait plaisir de voir que tu attaques la chimie et la physique. Ceci est un bon debut :)
Tiens , bah moi qui suis en plein dedans , j'avoue qu'on finit par oublier les bases. Merci bien !
Encore un article vraiment cool que je vais m'empresser d'ajouter à mes favoris pour pouvoir rapidement retrouver les masses et charges des nucléons et électrons😂