El uso de modelos animales para estudiar y describir fenómenos observables en la biología humana se remonta a los médicos de la antigua Grecia, quienes disecaron animales para estudios anatómicos, entre ellos Alcmeón de Crotona (VI-V siglo antes de la era de Cristo (a.C.), Aristóteles, Diocles, Praxágoras (IV siglo a.C.) y Erasistrato y Herófilo (cuarto-tercio siglo a.C.), desde entonces se desarrollaron técnicas que permiten el análisis de procesos fisiológicos en animales comparables a aquellos que ocurren en humanos. Las hormonas son sustancias químicas que ejercen efectos en células diana en distintas partes del cuerpo, y se asocias con funciones endocrinas diversas. En el actual estudio se presenta la evaluación del sistema hormonal de regulación de la glucosa en sangre mediante mediciones periódicas de glucosa en sangre antes (en ayuno) y 60, 90 y 120 min después de haber ingerido alimentos glucosados, mediante el uso de un glucómetro. De los tres individuos analizados, dos fueron masculinos y uno femenino y todos los individuos presentaron una tolerancia a la glucosa normal. De manera similar, se describe la estimación del grado de fertilidad de individuos femeninos en función del grado de cristalización de la saliva sobre un portaobjetos observado al microscopio. Resultando que el método posee una precisión ligeramente por debajo de la media en la estimación de la fertilidad. Finalmente, se detalla la determinación de la fase del ciclo estral de un hámster mediante observación de la citología característica de un frotis vaginal. El hámster se encontraba en fase proestro.
1. INTRODUCCIÓN
Las funciones del sistema endocrino de los vertebrados e incluso invertebrados se basan en el control del balance hídrico, el metabolismo, la adaptación, la reproducción, el desarrollo y el crecimiento mediante hormonas (Hill et al., 2006). Las hormonas, sustancias químicas producidas metabólicamente y liberadas por células endocrinas no neurales o neuronas, son las efectoras de influencias regulatorias en la función de otras células o células diana (que expresan receptores de membrana para hormonas determinadas) lejanas o próximas. Estas son usualmente secretadas por pequeñas agrupaciones de células secretoras (glándulas endocrinas) hacia el torrente sanguíneo para ejercer efectos en células y órganos distantes, o en los alrededores (Randall et al., 1999).
En los mamíferos, una de las hormonas por excelencia involucradas en el metabolismo es la insulina, que se encarga de disminuir las concentraciones de glucosa en sangre que aumentan progresivamente durante la digestión. Las concentraciones sanguíneas elevadas de glucosa propician la secreción en las células β del páncreas de la insulina, que estimulan la captación de glucosa por parte de las células musculares no contráctiles y adiposas, y su incorporación en las células hepáticas y musculares para la formación y almacenamiento de glucógeno (Hill et al., 2006). En algunos casos, como en el conjunto de enfermedades conocidas como diabetes mellitus, el páncreas no produce la suficiente insulina, o las células del cuerpo no responden bien a la insulina producida, causando serias complicaciones a nivel metabólico que pueden desencadenar la muerte (Shouback et al., 2011).
Por otra parte, la progesterona y el estrógeno son hormonas características relacionadas a los procesos reproductivos femeninos, y son secretadas en mayor o menor proporción debido al aumento o disminución de la hormona folículo estimulante (FSH) y la hormona luteinizante (LH), definiendo las etapas del ciclo estral o menstrual. En la mayoría de los roedores de pequeño tamaño el ciclo estral dura entre 4 y 5 días, y se reconocen cinco fases en las que el epitelio vaginal y de todo el aparato reproductor interno presenta características siempre iguales (Rippe, 2009). Así, durante la fase más fértil denominada estro, se observan en el epitelio vaginal células queratinizadas y algunas células nucleadas. Al no ocurrir la fecundación, se empiezan a observar una gran cantidad de leucocitos y pocas células queratinizadas, fase conocida como metaestro. Luego de esta fase, se empiezan a observar menos leucocitos y células nucleadas más abundantes en la fase de diestro, y finalmente en la fase proestro se observan casi únicamente células nucleadas (Sepúlveda et al., 2012). De manera similar, en el ciclo menstrual también se han encontrado algunos indicadores del grado de fertilidad, como la cristalización de la saliva, que alcanza su máximo cuando las concentraciones de estrógeno son máximas, es decir cuando la fertilidad es máxima pues se está ovulando (Kullander & Sonesson, 1965).
En el presente estudio se describe la evaluación del funcionamiento del sistema hormonal que regula los niveles de azúcar en sangre después de ingesta de glucosa mediante la medición de glicemia basal y postprandial. Adicionalmente, se presenta la estimación del grado de fertilidad en mujeres, evaluando el nivel de cristalización de la saliva como indicador de la salinidad de la misma, asociada a picos hormonales. Finalmente, se compara la citología del iepitelio vaginal en diferentes fases del ciclo estral de hámster (Mesocricetus sp.).
2. MATERIALES Y MÉTODOS
Los procedimientos se llevaron a cabo según Andara y Sánchez (2016).
2.1. Determinación de glucosa en sangre
Empleando glucómetros marca Freestyle se midió la glicemia basal de un total de tres individuos en ayuna y se registró junto con su edad y género. Luego de esto se les hizo ingerir 350 mL de refresco tipo cola y 70 g de chocolate de leche, equivalente a 75 g de azúcar en un lapso de 5 min. Se volvieron a registrar las glicemias luego de 60, 90 y 120 min de la ingesta. En los resultados se presenta la curva de glicemia (mg/dL) en función del tiempo para cada individuo, y se evalúan con ellas la respuesta del sistema hormonal de regulación metabólica a través de la insulina.
2.2. Cambios en el frotis vaginal durante el ciclo estral del hámster
Después de lavar con agua tres o cuatro veces la vagina de un hámster, se tomó una muestra de fluido vaginal que se dejó secar en un portaobjetos, luego de lo cual se sumergió 5 s en alcohol metílico. Se enjuagó y secó y se sumergió durante 15 min en solución de tinción Giemsa, para luego enjuagar de nuevo y dejar secar. Se observó la lámina al microscopio, se determinó en función de las células encontradas el ciclo estral del hámster y se comparó con frotis ya preparados que se encontraban en otras fases del ciclo.
2.3. Cristalización de la saliva
Con el uso de hisopos se tomaron muestras de saliva sobre la lengua bien humedecida de ocho individuos a los que además se les registró edad, género, si fumaba, si poseía algún desbalance hormonas, si tomaba algún tipo de medicamentos periódicamente y fase del ciclo menstrual. Las gotas de saliva se depositaron en portaobjetos y luego de dejarlas secar a temperatura ambiente por 10 min, se observaron bajo el microscopio estimando el grado de fertilidad como nulo, bajo, medio, y alto en función de la aparición, forma y tamaño de cristales. La fertilidad de las mujeres según su ciclo menstrual se asignó como alta, media y baja según estuviesen en los días 14-16, 9-13 y resto de los días respectivamente, del inicio de la última menstruación
3. RESULTADOS Y DISCUSIÓN
3.1. Determinación de glucosa basal y post-prandial
Las glicemias medidas se muestran en la figura 1, en la que se observa que las tres muestras tuvieron comportamientos diferentes. Una de las muestras másculinas (individuo masculino 1) presentó un valor intermedio de glicemia basal (respecto de las otras dos muestras) luego de lo cual esta aumentó hasta cerca de 180 mg/dL una hora después del consumo de glucosa. Posteriormente, este presentó una disminución hasta niveles más bajos que los basales hasta que alcanzó un mínimo a los 120 min entre 100 y 110 mg/dL.
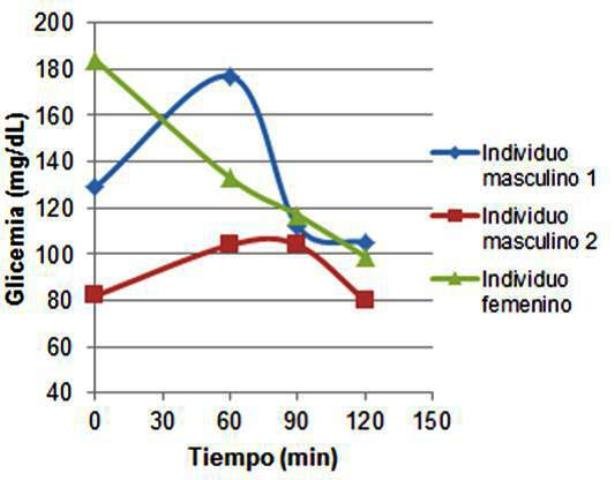
Figura 1. Curvas de glicemia (mg/dL) en función del tiempo después de la ingestión de glucosa. Se presentan las curvas para dos individuos masculinos y uno femenino. Se observan comportamientos diferentes en cada caso.
De manera similar, el segundo individuo masculino presentó un valor bastante bajo (80 mg/dL) de glicemia basal, luego de lo cual aumentó ligeramente, para terminar bajando hasta un valor cercano al basal al pasar los 120 min. Por su parte, el individuo femenino presentó un muy elevado de glicemia basal, luego de lo cual esta fue bajando progresivamente hasta alcanzar un mínimo.
Si bien las curvas no son exactamente iguales, en ambos casos de individuos masculinos la tendencia es la misma. Hay un comportamiento normal, en el que se observa un aumento de la glucosa en sangre como resultado de la ingestión, y este es luego controlado hasta que vuelve a niveles basales, mediante la liberación de insulina que induce la captación de glucosa y su conversión en glucógeno (Hill et al., 2006). Además, los valores basales a los que retornó la glucosa son normales, indicando que no existe ninguna patología asociada a la tolerancia a la glucosa, siendo esta normal (Shouback et al., 2011). Esto mismo fue cierto también para la muestra femenina, pero la tendencia observada en esta fue diferente, pues siempre fue en descenso. Esto es inusual, pues los niveles de glucosa basales eran particularmente altos para haber estado en ayuna. Una posible explicación, es que debido a la ayuna y la bajas concentraciones de glucosa en sangre antes de las mediciones, se haya disparado la metabolización del glucógeno reservado en el hígado, por liberación de la hormona glucagón (Hill et al., 2006), y por tanto justo en ese instante los niveles de glucosa en sangre eran altos.
Luego de la ingestión, la insulina fue liberada nuevamente y por eso se observa el comportamiento de descenso de los niveles de glucosa en sangre hasta valores normales. Es posible además, que los valores de glucosa se hayan visto alterados pues al tratarse de un individuo femenino, las concentraciones hormonales y su liberación pueden estar sujetas a influencia de los picos de hormonas sexuales, progesterona y estrógeno (Than et al., 1994).
3.2. Cambios en el epitelio vaginal de hámster durante el ciclo estral
En la muestra tomada del hámster se detallaron pocas células, de las cuales su mayoría resultaron ser células nucleadas (Fig. 2a). En vista de que no se observaron leucocitos y además no se encontraron células queratinizadas, se concluyó que se trataba de la fase proestro (Sepúlveda et al., 2012; Marcondes et al., 2002) en la cual las concentraciones de estrógeno se presentan elevadas y las de progesterona se encuentran bajas como parte de las medidas pre-ovulatorias (Rippe, 2009).
En las figuras 2b y 2c se muestran además la citología característica de la fase metaestro y diestro respectivamente. En la fase de metaestro se observan pocas células epiteliales queratinizadas y aparecen gran cantidad de leucocitos mientras que en la fase de diestro se empiezan a apreciar células nucleadas y desaparecen por completo las células queratinizadas (Sepúlveda et al., 2012; Marcondes et al., 2002).
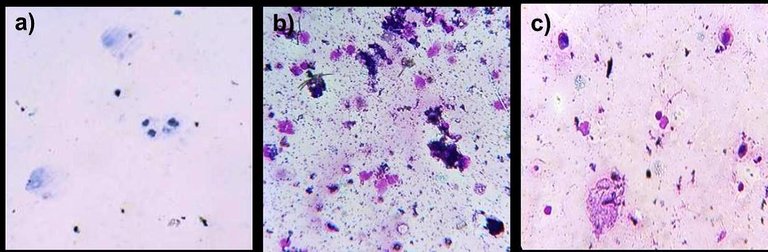
Figura 2. Citología de frotes vaginales de hámster en distintas fases del ciclo estral. a) proestro: células nucleadas. b) metaestro: células queratinizadas y abundantes leucocitos. c) diestro: células nucleadas y leucocitos.
3.3. Estimación de la fertilidad en función de la cristalización de la saliva
Las muestras características para cristalización alta, media y baja se muestran en la figura 3. En estas se pueden observar los cristales en forma de helechos ramificados en mayor o menos proporción, característicos de los fluidos con alta salinidad como resultado del aumento de la misma en función de picos de estrógeno en el ciclo menstrual (Kullander & Sonesson, 1965).
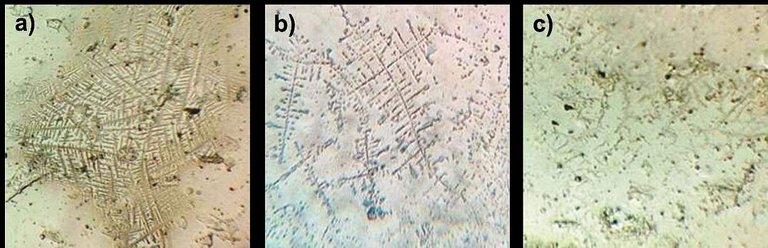
Figura 3. Cristalización de la saliva en varios niveles. Los cristales se asemejan a frondes de un helecho. a) alta cristalización, b) cristalización media, y c) cristalización baja. Adicionalmente, en la tabla I se muestra la relación entre los niveles de cristalización observados y los niveles defertilidad en función del ciclo menstrual. Se pudo observar que tan solo en tres casos de los estudiados, la prueba de cristalización coincidió en primera instancia con lo esperado.
| Muestra | Género | Edad | Cristalización | Fertilidad |
|---|---|---|---|---|
| 1 | F | 20 | A | A |
| 2 | F | 24 | MBv | |
| 3 | F | 23 | M | B |
| 4 | F | 34 | B | M |
| 5 | F | 29 | M | B |
| 6 | Ma | 20 | N | n/a |
| 7 | Ma | 20 | B | n/a |
| 8 | Ma | 21 | B | n/a |
Tabla I. Resultados de la prueba de cristalización de la saliva. F (Femenino), Ma (Másculino), A (Alto), B (Bajo), M (Medio), N (Nulo), n/a (no aplica)
En el caso particular de las muestras masculinas que presentaron cristales, estos pueden haberse debido más probablemente a la ingesta previa de alimentos con altos niveles de salinidad o que disparaban la salinidad de la saliva. Por su parte, la muestra número 3 y 4 (Tabla I) presentaban resistencia a la insulina, sirviendo de indicador de un posible desbalance hormonal que afecte los niveles de estrógeno y por tanto en la cristalización de la saliva. Adicionalmente, en la muestra 4 la ingesta del anticonceptivo Yaz, que probablemente funcione disminuyendo los niveles de estrógeno, puede haber causado que no aparecieran cristales.
4. CONCLUSIONES
• Todos los individuos evaluados presentan tolerancia a la glucosa normal.
• El individuo femenino presentó un comportamiento inusual, al tener valores basales de glicemia muy elevados. Los individuos masculinos presentan comportamiento normal del sistema de regulación de glucosa en sangre.
• El hámster al que se le realizó el frotis estaba en la fase proestro del ciclo estral.
• En las distintas muestras se encontró cristalización en niveles variables.
• La prueba de cristalización solo acertó en tres casos en la estimación de la fertilidad.
5. REFERENCIAS BIBLIOGRÁFICAS
• Andara, C. & E. Sánchez. Guía de prácticas de fisiología animal. (2016). Ediciones de la Facultad de Ciencias y Tecnología de la Universidad de Carabobo. Carabobo, Venezuela. 71 pp.
• Hill, R., G. Wyse, & M. Anderson. (2006). Fisiología animal. Editorial Médica Panamericana S.A. Madrid. 916 pp.
• Kullander, S. & B. Sonessan. (1965). Studies on saliva in menstruating, pregnant and post-menopausal women. Acta endocrinológica. 48: 329-336.
• Marcondes, F., F. Bianchi & A. Tanno. (2002). Determination of estrous cycle phases of rats: some helpful considerations. Braz. J. Biol. 62(4): 609-614.
• Randall, D., W. Burggren & K. French. (1999). Eckert: Fisiología animal. Mecanismos y adaptaciones. McGraw-Hill Interamericana. Madrid, España. 790 pp.
• Rippe, C. (2009). El ciclo estral. Dairy Cattle Reproduction Conference. Minneapolis. 5 pp.
• Sepúlveda, M., M. Sabanero, E. Durán, L. Flores, J. Ramírez & M. Solís. (2012). Ciclo estral del ratón hembra intacto y ovariectomizado. Acta Universitaria. 22(2): 5-8.
• Shoback, E., G. David & D. Gardner. (2011). Greenspan's basic & clinical endocrinology. McGraw-Hill Medical. New York. 1010 pp.
• Than, T., E. Delay & M. Maier. (1994). Sucrose threshold variation during the menstrual cycle. Phisiol. Behav. 56(2): 237-239.
Ciencia para la vida y estudios en animales para estudiar el comportamiento hormonal..! ¡Votado por Engranaje!
Buena publicación.
Suerte... Sin embargo, no parece que estés recibiendo la valoración a tu post que mereces. Deberías echarle un vistazo a proyectos de curación serios que reconozcan tu esfuerzo. Te sugiero la comunidad de @proconocimiento.