Hoy escribiré un poco sobre el enfoque que reciben los diferentes procedimientos y técnicas en biología celular a través de la carrera y a lo largo de los diferentes proyectos de los que formé parte. Para ello deben responderse algunas preguntas de interés, definirse variables y conceptos, mediante estas herramientas se logrará entonces cumplir con el objetivo principal de esta publicación, el cual es: Dar a conocer tanto a la comunidad científica como al público en general una de las pruebas en las que se puede estudiar la viabilidad celular, así como analizar e interpretar de forma concisa los resultados de dicha prueba, explicando lo que significa para la salud integral del ser humano.
El recuento y la evaluación de la viabilidad celular son procedimientos básicos empleados en muchos estudios relacionados a conocer concentraciones de células en tejidos y el efecto de algunas sustancias o condiciones sobre un cultivo. Se buscó determinar el porcentaje de viabilidad asociado a tres muestras de cultivos de células SkBr3 y también dar con la concentración de leucocitos en tres muestras de sangre mediante recuento. Se empleó una cámara de Neubauer para el conteo de células viables de la línea SkBr3 tratadas con azul de tripano, contando en los cuatro cuadrantes de las esquinas del retículo de la cámara. Empleando dicha cámara, y de igual forma contando en los cuatro cuadrantes de las esquinas se realizó un recuento total de leucocitos presentes en las muestras sanguíneas tratadas con líquido de Turk y se calculó su concentración. Para las tres muestras de sangre se obtuvieron concentraciones de 11.000, 7.150 y 23.500 leucocitos por mm3, y los porcentajes de viabilidad para las muestras de células SkBr3 fueron de 76,4 , 11,1 y 66,6 % con concentraciones totales de 85,0 , 22,5 y 120,0 células/mm3 respectivamente. Dos de las muestras de sangre presentaron leucocitosis según el conteo realizado, y una de las muestras de células SkBr3 parece haber sufrido alguna alteración antes o durante el proceso de conservación y/o de preparación para su conteo.
INTRODUCCIÓN
El recuento celular es un procedimiento básico que consiste fundamentalmente en cuantificar mediante conteo, el número de células presentes en un área o volumen específico, generalmente con ayuda de diluciones y siendo observadas en el microscopio, aunque ya existen contadores celulares automáticos [1]. Una herramienta usada ampliamente para el conteo celular hoy en día, son las cámaras de recuento, también denominadas hematocímetros, por estar concebidas para el conteo de células sanguíneas. Estas cámaras, están formadas por un portaobjetos de cristal en cuyo tercio central se encuentran tres plataformas, de las cuales la central, situada 0,1 mm por debajo de las laterales, presenta un cuadriculo regular llamado retículo, de 9 mm2 subdividido en 9 cuadrados de 1 mm2 cada uno. Para facilitar el conteo, todos estos cuadrados están divididos en 16 cuadrados terciarios. En la cámara de Neubauer el cuadrado central está dividido en 25 cuadrados terciarios [2].
Actualmente, las cámaras de conteo se usan mayormente para la medición de la concentración de leucocitos, eritrocitos, y plaquetas en la sangre y otros líquidos biológicos, y la de espermatozoides en semen [1]. Para estos fines, suelen usarse medios o sustancias que actúan de manera selectiva, contrastando el tipo de célula que se quiere contar del resto que se encuentra en la muestra. El líquido de Turk (o el de Lazarus), por ejemplo, es una solución hipotónica que contiene ácido acético glacial, agua destilada y violeta de genciana. Este líquido, actúa destruyendo a los eritrocitos por hemólisis, en una muestra de sangre, contrastando levemente con el violeta de genciana solo a los leucocitos [3], y facilitando así su conteo.
Por otra parte, existe un concepto usado ampliamente en estudios celulares, la viabilidad. La viabilidad celular es usualmente definida como el número de células sanas en una muestra. Los métodos para su evaluación se pueden categorizar de manera general en aquellos que analizan la población celular entera y aquellos que analizan células individuales, siendo los primeros más rápidos, pero aportan resultados menos detallados que cuando se mide a nivel de células individuales [4]. Así, la mayoría de los métodos a nivel de poblaciones, se basan en ensayos de liberación u absorción de sustancias marcadas radioisotópicamente o cromóforas relacionadas con la actividad metabólica, como lo es la liberación de Cr o de 3-(4,5-dimetil tiazol-2-yl)-2,5 bromuro de difeniltetrazolium (MTT). Los métodos para analizar células individuales, se basan en la exclusión de colorantes como la nigrosina, eosina Y, negro naftaleno, verde rápido, rojo neutro y otros [5].
Uno de los métodos más antiguos y aun usados para evaluar la viabilidad celular a nivel individual es el ensayo de exclusión de azul de tripano. Se basa en el principio de que las células viables o sanas tienen membranas celulares intactas las cuales pueden excluir el azul de tripano. Las células muertas integran el colorante, y aparecen teñidas de azul como consecuencia, pues su membrana ya no es capaz de controlar el paso de macromoléculas [4]. La evaluación de la viabilidad celular, es un procedimiento llevado a cabo de manera rutinaria en cualquier estudio que busque determinar el efecto de alguna sustancia sobre una población celular o sobre células individuales. Entre estos estudios, resaltan por su importancia biomédica, aquellos relacionados al cáncer. Para esto, se han aislado y mantenido líneas celulares que se emplean como modelos de estudio, por ejemplo, la línea celular SkBr3, tomada de carcinoma ductal o cáncer de seno [6].
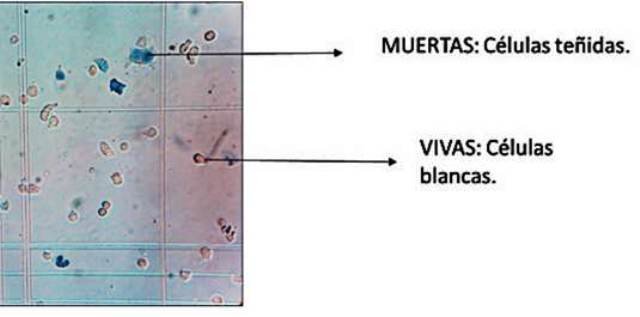
Figura 1. Ejemplo de prueba de exclusión de azul de tripano. Fuente.
En el presente estudio, se describe el proceso de tinción con azul de tripano de células SkBr3 con el fin de determinar el porcentaje de viabilidad celular asociado, mediante el conteo en una cámara de Neubauer. Además, se realizó un recuento de leucocitos presentes en muestras de sangre tratadas con líquido de Turk, para calcular la concentración total de estos en las distintas muestras sanguíneas.
MATERIALES Y MÉTODOS
Preparación y recuento de leucocitos en sangre
Se obtuvieron tres diferentes muestras de sangre de adultos siendo estas la población; la muestra por su parte fueron los leucocitos contados. Siguiendo las modificaciones de Ramírez y otros [7] del protocolo para el recuento de leucocitos diseñado originalmente por Turk [3], se diluyeron 20 μL de sangre en 0,38 mL de líquido de Turk. Se usó una cámara de Neubauer para el conteo bajo el microscopio (Konus Optical Tecnology) a 400x de aumento. Se contó solo en los cuatro cuadrantes de las esquinas y se expresan los resultados en función de la concentración total de leucocitos presentes en las distintas muestras sanguíneas.

Figura 2. Camara de Neubauer. Fuente.
Preparación y conteo de las células SkBr3 viables
Diseñado por Mishell y Shiigi en 1980 [5] y modificado por Ramírez y otros [7], se procedió a aplicar el protocolo para evaluar la viabilidad celular usando como población y muestra a su vez tres cultivos de células de la línea SkBr3. Las muestras se descongelaron aplicando calor corporal y se centrifugaron (Spectrafuge 16M Labnet) a 2.000 rpm por 5 min. Los precipitados celulares fueron resuspendidos en 30 μL de azul de tripano y se procedió a contar el número de células viables y no viables en los cuatro cuadrantes de las esquinas de la cámara de Neubauer usando el microscopio en 400x de aumento. Los resultados se presentan como porcentaje de viabilidad celular (Nro. células viables / Nro. células totales) y concentración total (Nro. células /mm3) para cada muestra de células SkBr3.
Según la Colección de Cultivos Tipo de EE.UU (ATCC por sus siglas en inglés) la línea celular SkBr3:
Es una línea celular humana hipertriploide con el número cromosómico modal de 84, que ocurre en el 34% de las células. Las células que tienen 80 cromosomas también se produjeron a una velocidad elevada (28%); las células ploides más altas ocurrieron en 7.3%. Esta línea celular tiene una composición cromosómica muy compleja. Treinta y cinco a 40% de los cromosomas en un complemento celular con un número cromosómico modal de 84 consistía en cromosomas marcadores estructuralmente alterados. Varios marcadores son más largos que el cromosoma N1.Origen: glándula mamaria; derivado del sitio metastásico: derrame pleuralNivel de bioseguridad: 1 Descripción ampliada de celula SkBr3.
RESULTADOS
Leucocitos en las muestras de sangre
En las muestras de sangre fueron contadas cantidades variables de leucocitos, los cuales se observaron al microscopio como células redondeadas con núcleos lobulados o no, ligeramente contrastadas con un color verdoso (Fig. 3). La mayor concentración de leucocitos se observó en la tercera muestra (Tabla I), mientras que la menor se encontró en la primera, teniendo la segunda muestra una concentración intermedia entre las otras dos. Los valores difieren de tal manera que la primera muestra es aproximadamente el doble de la segunda, y la tercera aproximadamente el triple de esta.
Tabla I. Concentraciones de leucocitos en las tres muestras de tejido sanguíneo tratadas con líquido de Turk y contabilizadas empleando una cámara de Neubauer. Los valores de las muestras 1 y 3 se salen del rango considerado normal.
| Muestra sanguínea | Concentración de leucocitos (Nro. de leucocitos /mm3) |
|---|---|
| 1 | 11.000 |
| 2 | 7.150 |
| 3 | 23.500 |
Viabilidad celular en muestras de cultivos de células SkBr3
Las células SkBr3 se observaron en general como estructuras redondeadas. Aquellas que eran viables, no aparecían coloreadas, mientras que las no viables, aparecían coloreadas de azul-morado y en algunos casos lisadas o con sus membranas destrozadas. El mayor porcentaje de viabilidad se obtuvo en las muestras uno y tres, mientras que el menor se obtuvo en la muestra dos (Tabla II), la relación fue la misma para las concentraciones de células/mm3.
Tabla II. Porcentajes de viabilidad celular y concentración de células SkBr3.
| Muestra de cultivo de células SkBr3 | Concentración de células (Nro. de células/mm3) | Porcentaje de viabilidad celular (%) |
|---|---|---|
| 1 | 85 | 76,4 |
| 2 | 22,5 | 11,1 |
| 3 | 120 | 66,6 |
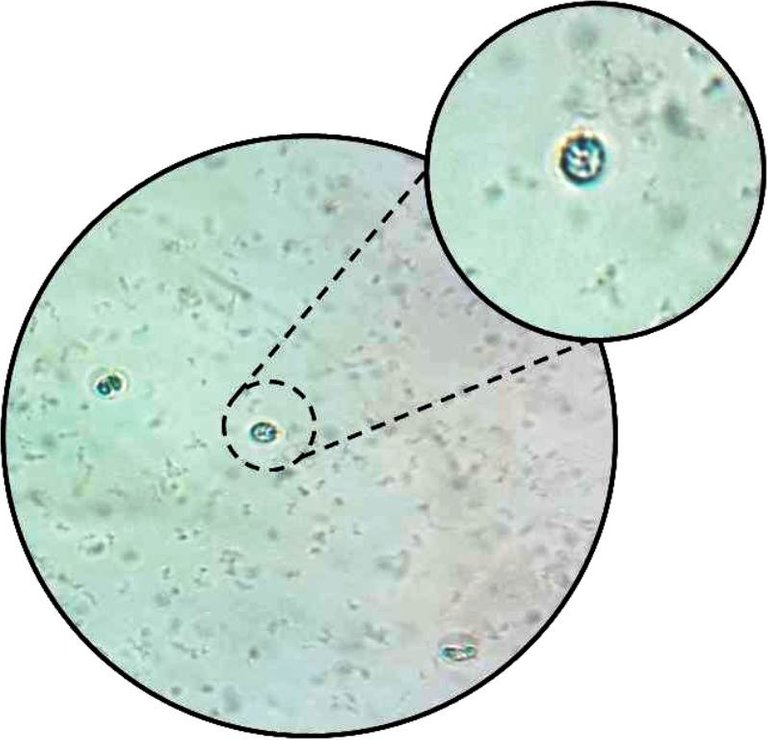
Figura 3. Leucocitos presentes en muestra sanguínea tratada con líquido de Turk. Aumento total: 400x.
DISCUSIÓN
Concentración de leucocitos en las muestras sanguíneas
La observación de leucocitos aislados, es decir, sin presencia de eritrocitos, fue posible gracias a la composición del líquido de Turk. Éste líquido es una solución hipotónica que contiene ácido acético glacial, agua destilada y violeta de genciana [3]. Su composición estaba diseñada de manera que los eritrocitos, que son células más pequeñas que los leucocitos y con forma bicóncava [8], y por tanto menos resistentes, sufrieron hemólisis. Mientras que los leucocitos no, siendo estos además contrastados por el violeta de genciana, razón por la cual solo se observaron leucocitos levemente contrastados.
Por su parte, las variaciones en las cantidades de leucocitos, y por tanto de su concentración en las tres muestras de tejidos sanguíneos observadas, se deben principalmente al hecho de que los leucocitos son células asociadas a la defensa del organismo ante agentes patógenos [9]. Por ende, su proporción varía de acuerdo al estado fisiológico (cortadas, infecciones virales, bacterianas, entre otras) del individuo del que se extrajeron las muestras en un momento particular. De esta forma, la cantidad de leucocitos puede servir como valor de referencia para ayudar a diagnosticar no solo la capacidad del organismo de producirlos en un momento dado, sino que puede aportar información valiosa para detectar infecciones virales, bacterianas o algunas enfermedades. En adultos humanos en estado fisiológico sano, se esperan encontrar entre 3.800 y 10.800 leucocitos por mm3 de sangre [9,10].
Figura 4. Ilustración de tipos celulares en sangre. Fuente.
La muestra de sangre número dos (ver tabla I) poseía una concentración de leucocitos considerada normal, sin embargo, la muestra número uno se salía ligeramente del rango y la tres, se salía enormemente del rango normal. El aumento de la concentración de leucocitos por encima de los 10.800 por mm3 se denomina leucocitosis [11]. Si bien para diagnosticar de manera precisa una enfermedad o infección hace falta entre otras cosas, determinar cuál es el tipo de leucocito asociado al aumento [11], los valores obtenidos mediante conteo aportan información muy general y básica que puede orientar hacia donde se debe hacer foco para dar con el diagnóstico correcto. Así, el leve aumento observado en la segunda muestra de sangre (11.000 leucocitos/mm3), puede señalar presencia de una infección poco grave.
Sin embargo, el aumento de la concentración de leucocitos observado en la muestra tres (23.500 leucocitos/mm3), puede ser indicativo de un caso severo de leucocitosis producto de una infección bacteriana o viral muy agresiva, o de enfermedades como la leucemia [8]. No se descartan errores asociados al proceso de conteo y de dilución previo, ya que en algunos casos, el no agitar la muestra o tomar del fondo, puede afectar la cantidad de células sanguíneas que se está tomando, pues estas suelen estar más concentradas en el fondo.
Porcentaje de viabilidad celular en cultivos de células SkBr3
El azul de tripano fue el agente que permitió diferenciar células viables de las no viables, siguiendo la premisa de que aquellas células teñidas de azul-morado eran las células no viables, debido que su membrana celular se encontraba dañada y no podía excluir las macromoléculas del colorante [4]. Las muestras número uno y dos (ver tabla II) presentaron altos porcentajes de viabilidad, esto puede deberse a que los métodos de conservación del cultivo eran los correctos, y que en el momento en el que fueron recolectadas y guardadas las células, la población celular se encontraba en buen estado fisiológico como resultado de condiciones de cultivo favorables, lo mismo se vio reflejado en las concentraciones, siendo estas coherentes con el porcentaje de viabilidad.
Por su parte, la muestra número dos presentó un bajo porcentaje de viabilidad y baja concentración de células, lo cual puede posiblemente indicar que en el momento en el que la muestra fue tomada, el cultivo no se encontraba en buen estado fisiológico o no poseía condiciones de crecimiento favorables. De igual modo, se pueden considerar errores de conteo, daño de las células durante la preparación para su conteo o la contaminación con alguna sustancia que pueda haber inducido la muerte en las células SkBr3 en la muestra.
CONCLUSIONES
• El líquido de Turk permite observar y contar leucocitos en sangre sin interferencia de los eritrocitos.
• De las tres muestras de sangre, dos de ellas poseían concentraciones de leucocitos fuera del rango normal, presentando leucocitosis y dando indicios de posibles infecciones o enfermedades.
• De las tres muestras de sangre, dos de ellas poseían concentraciones de leucocitos fuera del rango normal, presentando leucocitosis y dando indicios de posibles infecciones o enfermedades.
• El azul de tripano permite diferenciar células SkBr3 viables de las no viables.
• Dos de las muestras de cultivos de células SkBr3 presentaron altos porcentajes de viabilidad y concentración celular, mientras que una de ellas, presentó un bajo porcentaje y baja concentración, indicando que el estado fisiológico del cultivo no era tan bueno como el de las otras.
REFERENCIAS BIBLIOGRÁFICAS
[1] Herrero L, Ávila R, Corrales E, Hun L. Procedimientos en virología médica. Costa Rica: Editorial de la Universidad de Costa Rica; 2004. p. 181.
[2] Fuentes X, Castiñeiras M, Queraltó J. Bioquímica clínica y patología molecular. 2da edición. España: Editorial Reverté S.A; 1998. p. 583.
[3] Puga S, Villaldea S. Aplicaciones diagnósticas y terapéuticas del estudio fisicoquímico de la sangre. España: Ediciones Javier Morata; 1930. p 573.
[4] Stoddart M. Cell Viability assays: introduction. Mammalian Cell Viability: Methods and Protocols, Methods in Molecular Biology. 2011: 740(10): 1-6.
[5] Flora P, Ferrús A, Stern C. Cellular and molecular procedures in developmental biology. Estados Unidos: Academic Press; 1998. p 314.
[6] Moongkarndi P, Kosema N, Kaslungka S, Luanratana O, Pongpan N, Neungton N. Antiproliferation, antioxidation and induction of apoptosis by Garcinia mangostana (mangosteen) on SKBR3 human breast cancer cell line. Journal of Ethnopharmacology. 2004: 90(1): 161-166.
[7] Ramírez L, Fuentes E, Pavone D, Pacheco R. Guía de prácticas de laboratorio de biología celular. Venezuela: Universidad de Carabobo, departamento de Biología de la Facultad de Ciencias y Tecnología; 2013. p. 53.
[8] Montalvo C. Tejido sanguíneo y hematopoyesis. México: Ediciones Universidad Nacional Autónoma de México; 2008. p. 45.
[9] Welsch U, Sobotta J. Histología. 2da edición. España: Editorial Médica Panamericana; 2009. p. 677.
[10] Cuppett M, Walsh K. Medicina general aplicada al deporte. España: Editorial Elsevier; 2007. p. 467.
[11] Rodak B. Hematología: fundamentos y aplicaciones clínicas. 2da edición. España: Editorial Médica Panamericana; 2002. p. 839.
[12] Cypess, R. 1970. American Type Culture Collection. Virginia, EE.UU. Disponible en: Fuente.
Hola. Excelente. Aun así, no me quedo muy claro la utilidad clínica del estudio. ¿Que beneficios o aporte tiene para el paciente evaluar la viabilidad celular?
Esa evaluación, junto a otros microanalisis tienen como objetivo prrincipal el monitoreo y control de bioprocesos que pudieran ser consecuencias de enfermedades que afecten el numero de células, la morfología y función de las distintas lineas celulares. Saludos.
Genial. Buscare mas al respecto. Saludos.
Suerte...Buena publicación. Sin embargo, no parece que estés recibiendo la valoración a tu post que mereces. Deberías echarle un vistazo a proyectos de curación serios que reconozcan tu esfuerzo. Te sugiero la comunidad de @proconocimiento.
Excelente información, muchas gracias por compartir tus conocimientos. Saludos bro :)