Los carbohidratos, también llamados hidratos de carbono, glúcidos o azúcares son moléculas orgánicas solubles en agua y son la fuente más abundante y económica de energía en la dieta. En el presente estudio se describe el proceso de cuantificación de la glucosa en miel de abeja, además de pruebas colorimétricas para la identificación de carbohidratos en siete muestras problema. Para la extracción de glucosa se utilizaron 6 g de miel “Bosque Alto” separando los glúcidos de los demás componentes mediante centrifugación. Al extracto se le agregó DNSA para medir cuantitativamente la cantidad de glucosa en la muestra, mediante la absorbancia medida en el espectrofotómetro. Por lo que se determinó que, la miel “Bosque Alto” contiene 18,2 g de glucosa por cada 100 g de ésta. Las pruebas colorimétricas para la determinación de azúcares se realizaron en base a distintas reacciones en las que se daba la formación de un complejo coloreado o un precipitado en cada caso, indicando la presencia del carbohidrato en función de sus características. Dichas reacciones fueron Molisch, Barfoed, lugol, Bial, y Seliwanoff y permitieron en último fin la identificación del compuesto que se encontraba en cada una de las muestras problema.
1. INTRODUCCIÓN
Los carbohidratos o azucares pueden ser definidos de manera sencilla como polihidroxialdehidos o polihidroxicetonas y sus derivados [1]. Estas biomoléculas están ampliamente distribuidas y cumplen distintas funciones estructurales, así como de almacenamiento y fuente energía [2]. Los monosacáridos, también llamados azucares sencillos, están constituidos por una sola unidad de polihidroxialdehído o polihidroxicetona, un disacárido está constituido por dos monosacáridos unidos por un enlace glucosídico y los polisacáridos contienen muchas unidades de monosacáridos enlazadas [1]. La miel, el endulzante original de la naturaleza [3], es elaborada por la abejas con néctar floral y es esencialmente una solución acuosa altamente concentrada de dos azucares, glucosa y fructosa [4], los cuales constituyen el 30 y el 38% [3,5] de ésta respectivamente. Muchas otras sustancias también se encuentran en la miel, pero los carbohidratos son por mucho sus mayores constituyentes [4]. La glucosa y la fructosa son monosacáridos los cuales poseen extremos reductores, al igual que algunos disacáridos, y polisacáridos, como el almidón, la celulosa y la quitina. En base a esto, la medición de la concentración de extremos reductores puede aportar información valiosa acerca de una muestra analizada [6].
Debido especialmente a su presencia en muchos productos naturales, los azucares reductores (AR) han recibido considerable atención, lo cual ha llevado a un incremento en el diseño de métodos para su cuantificación. La habilidad de medir la concentración de AR aporta mucho significado para determinar la cantidad de azúcar en productos alimenticios y bebidas, e incluso, aunque indirectamente, es una herramienta para determinar la actividad de algunas enzimas responsables de la hidrólisis de polisacáridos [7].
La mayoría de los métodos analíticos usados para determinar AR involucran detección colorimétrica basada en la reacción de oxidación del grupo carbonilo del extremo reductor para producir una molécula que absorbe luz visible y ultravioleta [6]. Lo cual en último fin permite la cuantificación de la cantidad de azúcar presente en una muestra por medio de espectroscopia. Uno de los métodos más conocidos es el DNSA (Ácido 3,5- dinitrosalicílico), el cual se basa en la oxidación simultánea de grupos funcionales del azúcar y la reducción de dicho ácido hasta ácido 3-amino-5- nitrosalicílico (mediante la aplicación de calor), el cual absorbe luz a 540nm [8]. Existen también procedimientos de carácter cualitativo que permiten detectar la presencia de carbohidratos en una muestra por medio de distintas reacciones,además también hacen posible su identificación y diferenciación en base a características propias de cada azúcar. Algunos de estos métodos se basan en la deshidratación de los carbohidratos, para la formación de furfural o algún derivado, que luego se hace reaccionar con alguna sustancia que colorea la muestra. Entre estos se encuentran las reacciones de Molisch, Bial, y Seliwanoff, que permiten detectar la presencia de carbohidratos, diferenciar pentosas de hexosas, y cetohexosas de aldohexosas respectivamente [9]. Reacciones como la del Lugol se dan solo en la presencia de polisacáridos y otras como la de Barfoed permiten diferenciar monosacáridos de disacáridos en base a la formación de un precipitado [10].
El objetivo del presente estudio fue determinar la cantidad de glucosa en una muestra de miel de abeja empleando DNSA como método para la cuantificación. También se describe el proceso de identificación y caracterización de carbohidratos en siete muestras problema (sabiendo que estas podían contener glucosa, fructosa, xilosa, urea, almidón, lactosa o sacarosa), aplicando análisis cualitativos en base a las reacciones de Molisch, Bial, Seliwanoff, Barfoed y del Lugol.
2. MATERIALES Y MÉTODOS
2.1. Determinación del contenido de glucosa en miel de abejas
2.1.1. Calibración de espectrofotómetro
Siete muestras con diferentes contenidos de una solución patrón de glucosa de 800 μg/ml fueron empleadas para la calibración del espectrofotómetro (marca Thermo Scientific GENESYS 10UV-Vis) según la tabla 1. Luego a cada muestra se le agrego 300 μl de Ácido 3,5-dinitrosalicílico (DNSA) incubándolos en un baño maría a aproximadamente 100 °C por 5 minutos y pasado el tiempo de incubación se le añadieron 300 μl de agua destilada a cada mezcla. Se esperó a que se enfriaran y se midieron sus respectivas absorbancias a 540nm.
2.1.2. Extracción de glucosa en miel
Fueron pesados 6 g de miel “Bosque Alto” en una balanza de precisión (Ohaus Adventurer Pro), y seguidamente se midieron 15 ml de etanol al 95%. Ambas sustancias se calentaron en una plancha a una temperatura entre 60-70 ºC, calentado la miel hasta que estuviese líquida y el etanol hasta que empezó su ebullición. Inmediatamente se mezclaron bien las dos sustancias en caliente, dejando luego enfriar la mezcla en hielo por 4-5 minutos hasta que precipitara. Todo el contenido de la mezcla se depositó en dos tubos de centrifuga los cuales pesaron 14,32 g y 13,96 g , y luego estos se centrifugaron (Microcentrífuga Labnet) por 5 minutos a 2000 rpm (por la diferencia entre los pesos de los tubos de centrifuga se colocaron su respectivos contrapesos, tubos de centrifuga llenos de agua, en la centrifugadora para no dañarla). Posteriormente se desechó el sobrenadante obtenido en ambos tubos, y se añadieron 2,5 ml de agua destilada en cada uno de los ellos, mezclándolos y depositando finalmente el contenido de las dos fracciones en un tubo de ensayo constituyendo así la fracción S1.
| Fracción | Solución patrón de glucosa (μl) | Agua (μl) |
|---|---|---|
| 1 | 0 | 300 |
| 2 | 50 | 250 |
| 3 | 100 | 200 |
| 4 | 150 | 150 |
| 5 | 200 | 100 |
| 6 | 250 | 50 |
| 7 | 300 | 0 |
Tabla 1: Volumen de agua y solución patrón para la preparación de fracciones.
2.1.3. Cuantificación de glucosa
A partir de S1 se realizaron dos diluciones para un volumen final de 2 ml, una dilución 1/10 tomando 0,2 ml y una 1/100 tomando 0,02 ml , constituyendo así las fracciones MP1 y MP2 respectivamente. Se tomaron luego 15 μl de S1, 25 μl de MP1 y 100 μl de MP2, completando cada muestra con agua destilada hasta 300 μl, para luego adicionar 300 μl de DNSA y dejar calentar por 5 minutos a una temperatura aproximada a los 100 ºC. Finalmente se agregaron 300 μl de agua destilada, se dejó enfriar y se midió la absorbancia de cada muestra.
2.2 Identificación de carbohidratos en muestras problema
Se emplearon siete tubos de ensayo debidamente rotulados y limpios, que contenían cada uno cierta cantidad de una muestra cuya composición se desconocía, sabiendo que podía ser glucosa, fructosa, sacarosa, xilosa, lactosa, almidón o urea. Cada muestra fue sometida a distintas reacciones descritas a continuación.
2.2.1. Reacción de Molisch
Teniendo 1 ml de cada muestra se procedió a añadir 3 gotas de α- naftol (reactivo de Molisch), y seguidamente, por las paredes de cada tubo, se agregó gota a gota 1mL de H2SO4 concentrado, tratando de formar una interfase.
2.2.2. Reacción de lugol
Empleando 1 ml de muestra se agregaron 2 gotas de la solución de Lugol a cada una. Se observó y se anotaron los resultados.
2.2.3. Reacción de Barfoed
A 1 ml de cada muestra problema se le adicionaron 2 ml del reactivo de Barfoed y se procedió a sumergir cada tubo en un baño María esperando el tiempo suficiente para que se diera la reacción. Se anotó el tiempo necesitado para cada tubo.
2.2.4. Reacción de Bial
Se agregaron 2 ml del reactivo de Bial, a cada 1 ml de muestra problema diferente. Seguidamente se sumergieron los tubos en un baño María hasta que se observaron cambios. La prueba fue realizada en campana.
2.2.5. Reacción de Seliwanoff
Con 0,5 ml de cada muestra problema se procedió a adicionar 1 ml de resorcinol- HCl (reactivo de Seliwanoff) y se procedió a sumergir cada tubo en un baño María. La prueba se realizó en campana y se tomó el tiempo de aparición de cambios apreciables.
3. RESULTADOS
3.1.Determinación del contenido de glucosa en miel
3.1.1. Curva de calibración del espectrofotómetro
En base a los valores de absorbancia y los μg de glucosa, se determinó el valor de la constante de Lambert-Beer específicamente para la glucosa mediante regresión lineal. La ecuación de la recta, el valor del coeficiente de determinación (R2) y la curva de calibración se presentan en la figura 1.
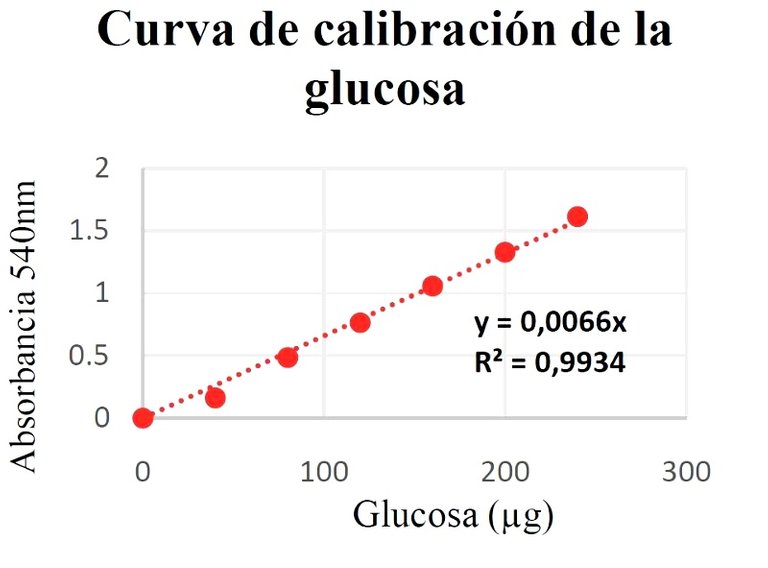
Figura 1. Curva de calibración, ecuación de Lambert-Beer y valor de R2.
3.1.2. Cantidad de glucosa presente en muestra de miel
La absorbancia medida para la fracción MP2 fue de 1,440 , siendo esta la única que calló dentro de los valores de absorbancia medidos en la curva de calibración. En base la absorbancia de MP2 se determinó el contenido de glucosa en la muestra de 6 g de miel “Bosque Alto” y por consiguiente el contenido de glucosa por cada 100 g de dicha miel, ambos resultados se presentan en la tabla 2.
| Miel de abejas “Bosque alto” (g) | Glucosa (g) |
|---|---|
| 6 | 1,1 |
| 100 | 18,2 |
Tabla 2: Contenido de glucosa en miel de abeja
3.2. Identificación de carbohidratos en muestras problema
3.2.1. Prueba de Molisch
Al añadir el reactivo, se evidenció al instante una coloración con una interfase violeta-marrón para seis de las muestras problemas (Fig. 2), siendo así, positivo para carbohidratos y negativo para Urea (G).

Figura 2. Positivo para Molisch en 6 de las muestras, negativo para el G.
3.2.2. Prueba de lugol
Identificadas las muestras problema de carbohidratos, se pudo separar al polisacárido del resto. Por tanto, al añadirle el reactivo a cada muestra, dio positivo para un solo tubo. Siendo identificado el almidón al presentar una coloración azul-violeta intenso (Fig. 3).

Figura 3. Positivo para Lugol para la muestra F (almidón).
3.2.3. Prueba de Barfoed
El reactivo de Barfoed dio positivo para tres de las muestras, presentando un precipitado rojizo al momento de calentarse; donde dicho precipitado apareció en 2 min en la muestra A, y 1:25 min en las muestras C y B, lo que las identificó como monosacáridos. Por consiguiente, dio resultados negativos en las dos muestras restantes, identificándolas como disacáridos.

Figura 4. Positivo para monosacáridos (precipitado rojo) y negativos para disacáridos (sin turbidez).
3.2.4. Prueba de Bial
Una vez lograda la separación de las muestras en dos grupos (uno de monosacáridos y uno de disacáridos) con el reactivo de Bial, se facilitó la identificación de uno de los monosacáridos, la pentosa. Dando positivo para la Xilosa, al evidenciarse una coloración verde-azulado intenso (Fig. 5).

Figura 5. Positivo de color verde-azulado para el tubo “C”, Xilosa.
3.2.5. Prueba de Seliwanoff
El reactivo de Seliwanoff, permitió reconocer en ambos grupos (monosacáridos y disacáridos), la presencia del grupo cetosa, tanto de la fructosa como de la sacarosa. La prueba, por consiguiente, dio positivo presentando una coloración naranja intenso para fructosa (B) en un tiempo de 17 segundos, mientras que, la sacarosa (D) dio positivoen mayor tiempo, 33 segundos (Fig. 6). Permitiendo a su vez, el reconocimiento de las dos muestras restantes que dieron negativo en cada grupo, donde se identificó a la glucosa (A) y a la lactosa (E).

Figura 6. Positivo para “B”, fructosa y, positivo para “D”, sacarosa. Negativo para “A”, glucosa y, para “E”, lactosa.
3.2.6. Análisis cualitativo de muestras problema
En la tabla 3 se resume la identificación de cada una de las muestras problema, así como algunas características de los carbohidratos, determinadas en base a las reacciones cualitativas. La glucosa es una aldohexosa, la fructosa una cetohexosa y la xilosa una aldopentosa.
| Muestra | Contenido | Tipo | Carácter reductor |
|---|---|---|---|
| A | Glucosa | Monosacárido | SI |
| B | Fructosa | Monosacárido | SI |
| C | Xilosa | Monosacárido | SI |
| D | Sacarosa | Disacárido | NO |
| E | Lactosa | Disacárido | SI |
| F | Almidón | Polisacárido | SI |
| G | Urea | No glucídico | NO |
Tabla 3: Identidad y características de las muestras problema.
4. DISCUSIÓN
4.1. Determinación del contenido de glucosa en miel de abeja
La medida utilizada para ver la calidad del ajuste de un conjunto de datos a un modelo lineal es R2, llamado coeficiente de determinación [11]. Según los datos plasmados en la gráfica 1 el valor obtenido para dicho parámetro se encuentra dentro de un rango aceptable (0,9-1), lo cual permite afirmar que los datos de absorbancia medidos se ajustan bastante bien al modelo lineal de Lambert- Beer, y esto a su vez implica que el valor de la constante específica para la glucosa es también bastante cercano al valor real.
Dicha constante, permite establecer la relación lineal entre la absorbancia de la muestra problema y el contenido de glucosa en esta, expresada en la ecuación de Lambert-Beer. Las diferencias entre las absorbancias de la fracciones S1, MP1 y MP2 se debió a la concentración de glucosa que estas poseían, a mayor concentración mayor fue la absorbancia obtenida, debido al hecho de que hubo más glucosa que reaccionó con la DNSA [7,8], formando más complejos coloreados que absorbían la longitud de onda de 540 nm, que al colocarlos en el espectrofotómetro se traducía en un aumento de la absorbancia.
En las fracciones S1 y MP1 la absorbancia dio fuera de rango, debido a que la absorbancia medida por el espectrofotómetro era muy alta, es decir, que ambas presentaban elevadas concentraciones de glucosa y es por eso que la MP2 al ser una dilución (1/100) de la S1 si obtuvo una medida de absorbancia que cayó dentro de la curva de calibración, debido a que las concentraciones de la glucosa estaban en menor proporción, razón por la cual se tomó para la cuantificación de la glucosa en los 6 g de miel de abeja “Bosque Alto”. Por consiguiente, se sabe que por lo general el contenido de glucosa en g por cada 100 g miel es en promedio 30.3 g [3], el cual en contraste con el valor obtenido en la experimentación es bastante alto.
La miel es una sustancia natural producida por abejas, mayormente Apis mellifera [12] y se ha reportado que dependiendo de la(s) fuente(s) de néctar, la miel puede tener composición variable [3]. El bajo contenido de glucosa encontrado en la muestra de miel de abeja “Bosque Alto” en comparación con otros estudios, puede entonces explicarse haciendo foco en tres aspectos clave: la especie empleada para la producción de dicha miel, el tratamiento que se le da a esta antes de ser vendida, y los errores que se pueden haber producido durante la experimentación y el análisis de los datos. Si bien la mayoría de la miel producida a nivel industrial se da por Apis mellifera [12], existe la posibilidad de que la especie con la cual se produjo la miel en cuestión, es otra, con lo cual la composición de la misma puede variar no solo por diferencias fisiológicas en la abeja respecto a la A. meliffera sino que también por la fuente del néctar, como resultado quizás, de una mayor diversidad de formas vegetales que lo aportan en el área de producción (sea este un parámetro controlado o no) o como consecuencia de un habito alimenticio en específico de la especie. Esto se ve en cierto modo sustentado por el hecho de que, la miel es producida por al menos 11 de las aproximadas 20,000 especies de abejas que se conocen [3].
Por otra parte, durante el proceso de industrialización la miel muchas veces es diluida o mezclada con otras sustancias, lo cual puede traducirse en una concentración final de glucosa menor a la que se obtiene de la miel pura, respecto a esto, se sabe que algunos jarabes pueden ser agregados directamente a la miel después de recogida o dada a las abejas como alimento, en ambos casos para incrementar la cantidad de miel, pero disminuyendo la calidad [13].
Finalmente, es importante consideras que durante la experimentación se pueden generar errores relacionados a las medidas tomadas para los distintos cálculos. Más específicamente se atribuir parte del error al hecho de que al momento de realizar los cálculos para la obtención de los g de glucosa se desconocía el volumen real de la fracción de S1, con lo cual se usó como volumen total de la fracción solo los 5 ml de agua vertida sin contar también el volumen del precipitado que había quedado al centrifugar la mezcla de etanol con miel.
4.2. Análisis cualitativo de muestras problema
4.2.1. Prueba de Molisch
Al aplicar primero la reacción de Molisch a las muestras problema se pudo determinar que una de ellas no contenía ningún carbohidratos, siendo esta entonces la urea. Sucede que en la reacción de Molisch primero se utiliza el ácido sulfúrico en la reacción de deshidratación del glúcido hasta furfural o algún derivado, y luego se usa el α- naftol en la reacción de condensación, a partir de la cual se forma un complejo de color morado [9]. Si la sustancia no es un carbohidrato entonces, no formará el furfural y no reaccionará con el α- naftol (fig. 1).
4.2.2. Prueba del Lugol
Al agregar el Lugol, sólo el almidón se colorea. Sucede que el almidón está formado por amilosa y amilopectina, y las moléculas de amilosa son helicoidales, con la zona interior hidrófoba, estas moléculas son capaces de formar estructuras similares a tubos, y en ellas el yodo es capaz de formar complejos en los cuales el este se introduce en el interior hidrófobo de los segmentos de hélice, esto permite el ensamble de largas cadenas de poli yoduro que dan lugar al color azul [9] observado durante la experiencia (ver fig 2), el cual no se observó en las muestras que no contenían almidón.
4.2.3. Prueba de Barfoed
Mediante la formación de un precipitado de color rojizo se pudo diferenciar entre monosacáridos (muestras B, C y A) y disacáridos (E y D) .La reacción de Barfoed se fundamenta en la reducción del Cu (II) hasta Cu (I), por efecto del extremo reductor del monosacárido, formándose un precipitado de óxido cuproso (Cu2O) que es de color rojo ladrillo [10]. No da positivo para los disacáridos (ver fig.3) porque estos o poseen un poder reductor muy bajo, o no lo poseen del todo. La reacción es muy lenta y requiere de calor para acelerarla. También se espera que los disacáridos reaccionen eventualmente si estos se hidrolizan.
4.2.4. Prueba de Bial
Permitió diferenciar a los monosacáridos entre pentosas (muestra C) y hexosas (A y B). En esta reacción el HCl deshidrata a los monosacáridos hasta furfural en el caso de una pentosa y hasta hidroximetilfurfural en una hexosa, luego se hace reaccionar estas sustancias con Orcinol en presencia de ion férrico y se forma un complejo azul en el caso de las pentosas y un complejo amarillo-marron en el caso de las hexosas (ver fig. 4) [10]. Con esto se logró descartar del grupo de los monosacáridos a la xilosa como pentosa, dejando a la glucosa y a fructosa aparte. La reacción es muy lenta y requiere calor.
4.2.5. Prueba de Seliwanoff
Diferenció a la glucosa (muestra A) de la fructosa (B) en el grupo de los monosacáridos y a la lactosa (muestra E) de la sacarosa (D) en el grupo de los disacáridos. En esta reacción las cetohexosas son deshidratadas por el HCl hasta hidroximetilfurfural más rápido que las aldohexosas. Luego de ser deshidratadas, el hidroximetilfurfural reacciona con el resorcinol y se condensa un compuesto rojo [9]. La formación de este compuesto (ver fig.5) se da primero en la fructosa por ser una cetohexosa, luego en la glucosa por ser una aldohexosa, luego en la sacarosa que al hidrolizarse libera un monómero de fructosa, y finalmente en la lactosa que al hidrolizarse libera dos monómeros de glucosa.
5. CONCLUSIONES
La miel de abeja marca “Bosque Claro” contiene 18,2 g de glucosa por cada 100 g de ésta. En comparación a otras mieles posee una bajo contenido de glucosa, debido a distintos factores relacionados a su producción y el proceso de cuantificación en el laboratorio.
Las características de cada carbohidrato permiten su diferenciación mediante distintas reacciones de carácter cualitativo. Su identificación en una muestra problema puede ser clave para entender procesos como la catálisis enzimática. La totalidad de las muestras problema fueron caracterizadas como se resume en la tabla 3.
6. REFERENCIAS BIBLIOGRÁFICAS
[1] Lehninger A. Bioquímica: las bases moleculares de la estructura y función celular. 2da edición. Barcelona: Ediciones Omega, S.A.; 1978. p 255-283.
[2] Díaz J, Hicks J. Bioquímica. 2da edición. México: Nueva Editorial Interamericana, S.A.; 1995. pp 124-142.
[3] Ball D. The chemical composition of honey. J Chem Educ. 2007 Oct: 84(10): 1643-1646.
[4] White J, Doner W. Honey Composition and Properties. Agriculture Handbook. 1980 Oct: 331: 82-91.
[5] Bogdanov S, Jurendic T, Sieber R, et al. Honey for Nutrition and Health: A Review. Am J Coll Nutr. 2008: 27:677–689.
[6] Melander C, Andersson E, Axelsson S, et al. Determination of reducing ends with flow injection analysis with amperometric detection: application to enzymehydrolyzed methyl cellulose. Anal Bioanal Chem. 2007: 387(7): 2585-2593.
[7] Negrulescu A, Patruela V, Mincea M, et al. Adapting the reducing Sugars method with dinitrosalicylic acid to microtiter plates and microwave heating. J Braz Chem Soc. 2012: 23(12): 2176-2182.
[8] Texeira R, Silva A, Ferreira-Leitão V, et al. Amino acids interference on the quantification of reducing sugars by the 3,5-dinitrosalicylic acid assay mislead carbohydrate activity measurements. Carbo Res. 2012: 366: 33–37.
[9] Quesada S. Manual de experimentos de laboratorio para bioquímica. Costa Rica: EUNED; 2007. pp 87-92.
[10] Rivera E. Prácticas de bioquímica descriptiva. México: Editorial UniSon; 2005. p 14-25.
[11] Viedma C. SPSS/PC+: Una guía para la investigación. Madrid: Editorial Complutense; 1995. pp 528.
[12] Alvarez-Suares J, Tulipani S, Romandini S, et al. Contribution of honey in nutrition and human health: a review. Mediterr J Nutr Metab. 2010: 3:15–23.
[13] Cotte J, Casabianca H, Chardon J, et al. Application of carbohydrate analysis to verify honey authenticity. J Chromat A. 2003: 1021: 145–155.
Excelente explicación desde lo metodológico, felicitaciones @khisaeroth, comenzaré a seguirte, mi área de formación tiene relación. Saludos
Wow! Gracias, me gusta que les gusten mis trabajos.
Hi @khrisaeroth!
Your post was upvoted by utopian.io in cooperation with steemstem - supporting knowledge, innovation and technological advancement on the Steem Blockchain.
Contribute to Open Source with utopian.io
Learn how to contribute on our website and join the new open source economy.
Want to chat? Join the Utopian Community on Discord https://discord.gg/h52nFrV
Excelente post un gran trabajo y análisis de datos, interesante como puede variar la concentración de los carbohidratos dependiendo de la especie y del manejo industrial de las mismas. también la diverisad de carbohidratos que contiene incluyendo lactosa.
Muchísimas gracias!
¡Felicidades, #proconocimiento te valoró!
Has sido reconocido(a) por tu buen post por el Comité de Arbitraje y Valoración del Proyecto Conocimiento @proconocimiento.
Apoyamos y valoramos tu esfuerzo...
Proyecto Conocimiento es parte de la comunidad @provenezuela.
PionerosProducción Intelectual en habla hispana. en la plataforma #steemit en el reconocimiento y valoración a la
Guaoh un trabajo cientifico completo y muy interesante.
Excelente @khrisaeroth otra interesante entrega, donde el trabajo de laboratorio (con pruebas que me conectan con las actividades de biofisicoquímica, bioquímica y Biología Celular) se luce por su importancia para el análisis y aplicación en los emprendimientos y en la industria de la miel. Te felicito.