Practica de laboratorio realizada en la Universidad Simón Bolívar - Dpto. de Biología Celular - Laboratorio de Bioquímica I
Autores: Isamar Castillo y Mariana Saavedra.
Resumen
Mediante la electroforesis es posible separar moléculas biológicas en dependencia fundamentalmente de su carga bajo la influencia de un campo eléctrico. Se dará en la práctica una visión general de la electroforesis en geles de poliacrilamida para proteínas en condiciones nativas o desnaturalizadas. (García H., 2000). Luego de la realización de la electroforesis en el gel de poliacrilamida con presencia de SDS-PAGE para separar las proteínas y subunidades proteicas se realizó la curva, al graficar Log PM vs movilidad electroforética, usando proteínas de PM conocido para calibrar la migración de las proteínas en el gel. Fue entonces gracias a la curva y los PM de la muestra estándar que pudimos calcular los de nuestras bandas (en la corrida electroforética) de la cual obtuvimos que: no se presentaron bandas para el pico I, ni para el homogenato. En cambio, si hubo presencia de una banda correspondiente al pico II A, observándose para para el pico IIB la estructura des-fosforilada de la ovoalbúmina. La banda número 2 corresponde a un peso molecular de 65 kDa, por lo que se puede presumir que puede expresar la presencia de ovotransferrina. La lisozima comercial obtuvo un valor de 13,07 kDa, por lo que se puede determinar que para el pico II A (banda 1), y pico II (banda 4) hay presencia de dicha proteina; habiendo también para el homogenato (banda 7) presencia esta proteína.
PALABRAS CLAVES: Electroforesis, poliacrilamida, gel, SDS, proteínas.
Introducción
La electroforesis es un método analítico – semipreparativo, en el que se separan biomoléculas, en dependencia entre otros factores de su carga y bajo la acción de un campo eléctrico, fue empleado por primera vez por Tiselius en el año 1937. Raymond y Weintraub en 1959 emplearon como soporte para la electroforesis un gel de poliacrilamida (PAGE), posteriormente el método fue perfeccionado por varios investigadores como Davis y Ornstein. La popularidad de este creció rápidamente y se logró un aumento de la resolución. El dodecil sulfato de sodio (SDS) se introduce en esta técnica en 1970, y ya en 1972 se emplean agentes reductores y SDS en la determinación del peso molecular de proteínas en lo que se denominó electroforesis en geles de poliacrilamida con SDS (SDS-PAGE). (Garcia H., 2000).
Hilda García en su trabajo “Electroforesis en geles de poliacrilamida: fundamentos, actualidad e importancia” y citando a Campell MK en Saunders College Publishing, 1995, habla de que la poliacrilamida es un soporte empleado frecuentemente en electroforesis en gel, que a su vez es químicamente inerte, de propiedades uniformes, capaz de ser preparada de forma rápida y reproducible; esta forma, geles transparentes con estabilidad mecánica, insolubles en agua, relativamente no iónicos y que permiten buena visualización de las bandas durante tiempo prolongado. Además, tiene la ventaja de que, variando la concentración de polímeros, se puede modificar de manera controlada el tamaño del poro.
Los geles de poliacrilamida se forman por la polimerización de la acrilamida por acción de un agente entrecruzador, la bis-acrilamida, en presencia de un iniciador y un catalizador. Como iniciador se suele utilizar TEMED (N,N,N,N'-tetrametilnediamina) y como catalizador el ión persulfato (S2O8) que se añade en forma de persulfato amónico. La velocidad de la polimerización viene determinada por la concentración de persulfato (catalizador) y TEMED (iniciador). La porosidad del gel la determina las proporciones relativas de poliacrilamida y bis-acrilamida, siendo menor el poro cuanta más bisacrilamida se use. El porcentaje total de acrilamida/bisacrilamida determina el rango de separación del gel. Habitualmente los geles se denominan en función del % de acrilamida/bisacrilamida que contienen. Un menor porcentaje (mayor tamaño de poro) es mejor para separar proteínas de gran tamaño (Galussi y col, 1996).
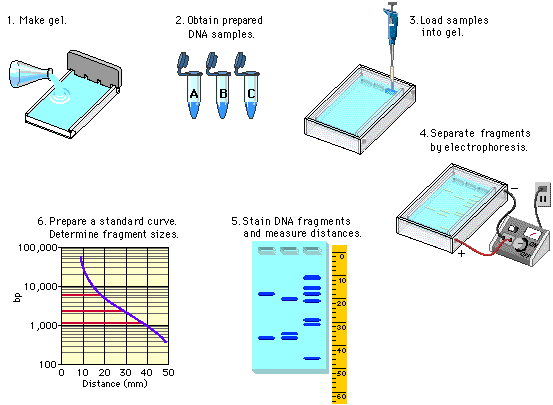
Figura 1. Preparación del gel para la Electroforesis, en el caso de la práctica fue realizado para la determinación del PM de las proteínas. (Portafolio Electrónico de Mildred Journett a través de https://sites.google.com/site/portafolioelectronicobiologia/home consultado el 31 de enero del 2018)
Su fundamento está en que, en el primer gel, el efecto de apilamiento ocurre porque los iones glicinato, relativamente cargados negativamente tienen una movilidad electroforética inferior que los complejos de proteínas-SDS que a su vez tienen menor movilidad que los iones Cl- de los tampones de carga en el gel de apilamiento. Cuando se conecta la diferencia de potencial todas las especies han de migrar a la misma velocidad para mantener el circuito eléctrico. El resultado es que las tres especies de interés ajustan sus concentraciones de forma que [Cl] > [proteína-SDS] > [glicinato]. Como sólo hay una pequeña concentración de proteína-SDS las tres se concentran en una banda muy delgada entre las fronteras de migración del Cl- y del glicinato. Cuando el glicinato alcanza el borde del gel de separación adquiere una mayor carga en el nuevo medio, con un pH superior, e incrementa su movilidad. A partir de ese momento la interfase entre el glicinato y el Cl- deja atrás a los complejos de proteína-SDS que se desplazarán a su propia velocidad (Galussi y col, 1996)
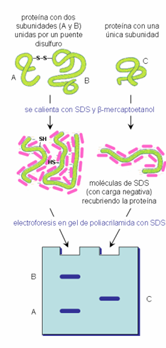
Figura 2. Separación de proteínas y subunidades a través de electroforesis en gel de poliacrilamida SDS-PAGE (UAH, consultado a través de http://biomodel.uah.es/tecnicas/elfo/inicio.htm el 01 de febrero del 2018)
Para calibrar la migración de las proteínas en el gel se utilizan los estándares de PM, que no son más que proteínas de PM conocido. Para cada gel, la migración de la proteína será inversamente proporcional al logaritmo de su PM. Al graficar ambos parámetros (Log PM vs movilidad electroforética) se obtendrá una gráfica como la observada en la figura 3. (Guía Lab. Bioquímica I USB, 2015)
Resultados
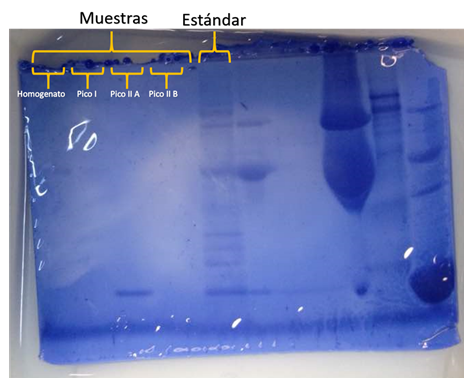
Los resultados para la electroforesis realizada durante la práctica pueden observarse en la figura 3, en la cual se encuentran identificadas las posiciones para las muestras de homogenato, pico I, pico II A y pico II B. En las posiciones del homogenato, pico I y pico II B no se observa presencia de proteínas. Esto puede deberse a errores provenientes de la cuantificación de proteínas por los métodos de Bradfor y Lowry, lo cual conlleva a que se estimara una concentración errada de la muestra y se utilizara la misma demasiado diluida. Esto puede deberse también a un error derivado de la mezcla de las muestras, que no fuera homogéneo y por lo tanto se tomara una muestra muy diluida. Por este motivo se analizarán los resultados de las muestras de los otros grupos además del resultado para el pico II A de las muestras propias.

Figura 3. Resultados de la corrida electroforética. Gel SDS – PAGE 1 grupo martes
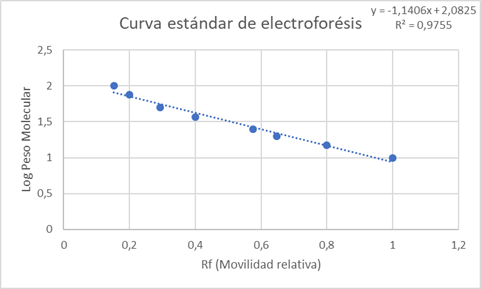
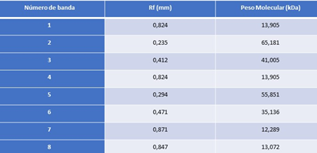
En la figura 4, se encuentran los pesos moleculares asignados a cada banda de la muestra estándar, que serán usados para estimar el peso molecular de las proteínas presentes en las muestras. Con los datos obtenidos en el estándar de referencia se construyó una curva estándar que nos permite estimar el peso molecular de las proteínas de las muestras en base a la movilidad relativa (Rf) de cada una de ellas. Rf representa la distancia recorrida por la proteína entre la distancia recorrida por el frente de corrida. (Maldonado y Jorrín). En la curva (Gráfica 1) se graficó el logaritmo del peso molecular en kDa en función del Rf de las bandas estándar. La línea de tendencia lineal posee una ecuación igual a y = -1,1406 x + 2,0825 con un R-cuadrado de 0,9755, por lo que las variables poseen una dependencia del 97,55%% y nos permite estimar el peso molecular con los resultados obtenidos.

Figura 4. Muestra estándar con pesos moleculares asignados a cada banda
Gráfica 1. Curva estándar de electroforesis. Logaritmo del peso molecular en función de la movilidad relativa.

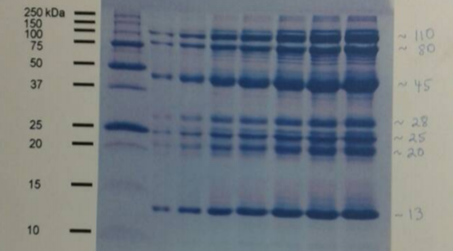
En la figura 5 enumeramos las bandas correspondientes a pico II A (teóricamente lisozima purificada), y de las muestras de otro grupo se enumeró las bandas del pico II, homogenato y lisozima comercial. En la tabla 1 se pueden observar los pesos moleculares estimados para las bandas enumeradas, utilizando la curva de referencia estándar construida.

Figura 5. Resultado de corrida electroforética. Gel SDS-PAGE con bandas enumeradas para pico II A, pico II, homogenato y lisozima comercial-

Tabla 1. Pesos moleculares estimados para cada banda de la corrida electroforética
Discusión
Para la electroforesis se utilizaron muestras de practicas anteriores, las cuales contenían el homogenato de la clara de huevo, el pico I y el pico II de la purificación de la lisozima por cromatografía de intercambio iónico y una muestra de lisozima comercial. Con la corrida electroforética de dichas muestras se puede observar el peso molecular del contenido protéico contenido en la clara de huevo (homogenato) y verificar que la purificación de la enzima en prácticas anteriores haya sido exitosa. Los resultados esperados para pico I debían reflejar el mismo contenido proteico del homogenato sin la presencia (o una presencia muy tenue) de lisozima, pero la corrida electroforética no presentó bandas para el pico I ni para el homogenato. En cambio, si hubo presencia de una banda correspondiente al pico II A.

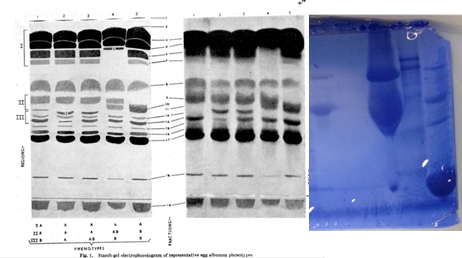
Figura 6. Comparación entre las electroforesis de la clara de huevo de Lush con la electroforesis realizada en la práctica de laboratorio. La banda amarilla representa la zona donde aproximadamente el Rf corresponde a 45 kDa.
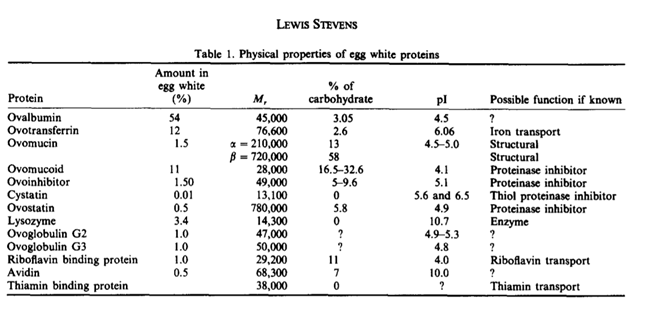
La clara de huevo esta compuesta de 88,5% agua, 10,5% proteínas y 0,5% de carbohidratos y otros solutos. (Stevens, 1991). Como la clara de huevo contiene proteínas como soluto más abundante, han sido frecuentemente estudiadas en diversas investigaciones. Una de las proteínas más abundantes es la ovoalbúmina, la cual es una glicoproteína con un punto isoeléctrico de 4,5. (Stevens, 1991). Según Lush (1961), la electroforesis de la clara de huevo puede dividirse en 3 regiones de la zona superior (I, II y III), en donde la ovoalbúmina se encuentra presente en su forma mono-fosforilada, di-fosforilada y des fosforilada. Por este motivo para la ovoalbúmina se presentan 3 bandas en la electroforesis. En la figura 6 se puede observar una comparación de los resultados obtenidos en la electroforesis con los de la realizada por Lush en 1961. Las tres bandas no son fácilmente detectables en los resultados obtenidos, posiblemente debido a una concentración muy alta del homogenato, pero se puede observar que hay presencia de proteínas en la región correspondiente al peso molecular de la ovoalbúmina. En cambio, para el pico II, se observa la presencia de bandas muy tenues, y la banda más definida corresponde a un peso molecular de 41 kDa. Debido a la alta concentración de esta proteína en la clara de huevo, es probable que corresponda a la estructura des-fosforilada de la ovoalbúmina. En la tabla 2 se puede observar un resumen de los pesos moleculares y otras propiedades de las proteínas presentes en la clara de huevo. (Stevens, 1991).

Tabla 2. Proteínas presentes en la clara de huevo (Stevens, 1991)
La segunda proteína más abundante es la ovotransferrina. Esta glucoproteína se encuentra tanto en la clara de huevo como en la yema y en el plasma, aunque difieren ligeramente en la glicosilación. Es rica en puentes disulfuro, los cuales no son reducidos por el mercaptoetanol sin una desnaturalización previa. (Stevens, 1991). La banda número 2 corresponde a un peso molecular de 65 kDa, por lo que se puede presumir que puede expresar la presencia de ovotransferrina debido a su cercanía con el peso molecular de la misma.El peso molecular promedio para las bandas 1, 4, 7 y 8 fue de 13,29 kDa. La lisozima comercial obtuvo un valor de 13,07 kDa, por lo tanto, se puede determinar que para el pico II A (banda 1) y pico II (banda 4) hay presencia de lisozima. En el caso de la muestra de pico II A, se refleja que la purificación de la lisozima por cromatografía de intercambio iónico tuvo éxito debido a que en la corrida electroforética solo se detectó la presencia de la lisozima y no hubo presencia de otras bandas de proteínas. Para el homogenato (banda 7) también se muestra la presencia de lisozima, ya que esta muestra contiene todas las proteínas presentes en la clara de huevo.
La electroforesis puede tener diversas fuentes de error, ya que es una técnica muy sensible. Una de las mas importantes es el factor de la temperatura, debido a que la viscosidad del agua varía dependiendo de la temperatura y afecta a la movilización de las proteínas. Por lo tanto, a temperaturas que rondan los 25 °C, los resultados de la electroforesis son más variables que aquellos resultados obtenidos a temperaturas más bajas. (Perez, 2000). La velocidad de la polimerización también afecta la lectura de la corrida, generando deformaciones en las bandas cuando la polimerización es muy rápida a causa de una contracción no uniforme del gel. Es importante también lograr la completa desnaturalización de las proteínas para evitar la aparición de bandas fantasmas. Otros factores importantes que generan fuentes de errores en las electroforesis son el tiempo de corrida y la pureza de los reactivos. (Perez, 2000).
Referencias Bibliograficas
• Galussi, A. A., Reinoso, D. P., Montesino, R., & Cevedo, A. M. L. (1996). Electroforesis de proteínas en gel de poliacrilamida. Manual de caracterización de cultivares de trigo y arroz: Análisis de semillas y plántulas
• García. H., (2000) “Electroforesis en geles de poliacrilamida: fundamentos, actualidad e importancia”. Marianao. (consultado a través de http://www.bvs.sld.cu/revistas/uni/vol1_2_00/uni07200.htm el 31/01/2018)
• Guía Práctica de Laboratorio de Bioquímica I (2015) Departamento de Biología Celular. Universidad Simón Bolívar. Caracas, 2015
• Lush, I. E. (1961). Genetic polymorphisms in the egg albumen proteins of the domestic fowl. Nature, 189, 981-984.
• Maldonado A., Jorrín J.Electroforesis desnaturalizante en geles de poliacrilamida. Análisis de proteínas de hojas de Arabidopsis thaliana”. Departamento de Bioquímica y Biología Molecular, Campus Universitario de Rabanales, Córdoba. https://www.uco.es/dptos/bioquimica-biol-mol/pdfs/16%20ELECTROFORESIS%20GELES%20PAA.pdf. Revisado el 4 de febrero del 2018.
• Pérez, H. M. G. (2000). Electroforesis en geles de poliacrilamida: fundamentos, actualidad e importancia.Universo Diagnóstico, 1(2), 31-4.
• Stevens, L. (1991). Egg white proteins. Comparative Biochemistry and Physiology Part B: Comparative Biochemistry, 100(1), 1-9.
Congratulations @isacastillor! You have completed some achievement on Steemit and have been rewarded with new badge(s) :
Click on any badge to view your own Board of Honor on SteemitBoard.
For more information about SteemitBoard, click here
If you no longer want to receive notifications, reply to this comment with the word
STOPHola buen post recuerda colocar el tag se manera correcta para tu próxima publicación, es "stem-espanol"