Animación: masa y temperatura constante, Fuente de imagen de dominio de Wikimedia Commons
La descripción del estado gaseoso y de las trasformaciones, que experimentas los gases se realizan mediante la denominada teoría cinética de los gases y se basa en las llamadas leyes de los gases. La teoría cinética de los gases se fundamenta en la concepción, que estos están compuesto por átomos o moléculas, que se mueven con gran rapidez y en direcciones al azar, cada una de dichas partículas posee una energía cinética, que depende de su temperatura, además se considera, que tales partículas experimentan choques perfectamente elásticos, es decir, que cuando colisionan entre sí, conservan sus velocidad y el choque no representa una pérdida de energía , dicha teoría supone, que el volumen ocupado por partículas, comparado con él, que ocupa el gas del que forman parte, es despreciable, además de considerar que la atracción mutua entre ellas es asimismo nula.

Robert Boyle (1627-1691),Fuente de imagen de dominio de Wikimedia Commons
El tiempo que media entre colisiones se consideran tan grandes, que el que supone la colisión se admitan como despreciable, los choques de átomos y moléculas de una gas son únicamente uno de los tipos de choque existente en los gases, ya que también chocan con las paredes de recipiente que lo contiene, ejerciendo una fuerza contra ellas, que es una función del propio choque contra la pared, la energía cinética que anima a la partícula. Los choques al ser perfectamente elásticos, no suponen perdida de energía cinética, para la partícula, si es una evidencia que cambian la dirección dela velocidad, de tal manera la presión ejercida sobre las paredes del recipiente es fuerza media por unidad de superficie.
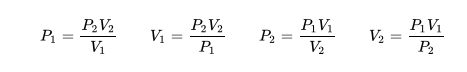

Esta ley es una simplificación de la ley de los gases ideales o perfectos particularizada para procesos isotérmicos de una cierta masa de gas constante, Fuente de imagen de dominio de Wikimedia Commons
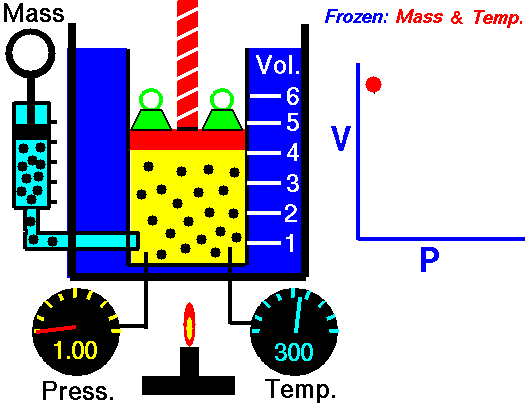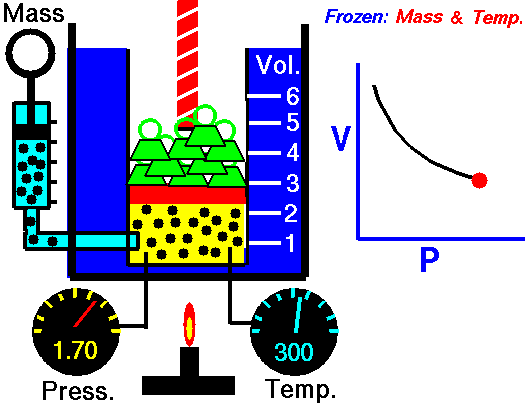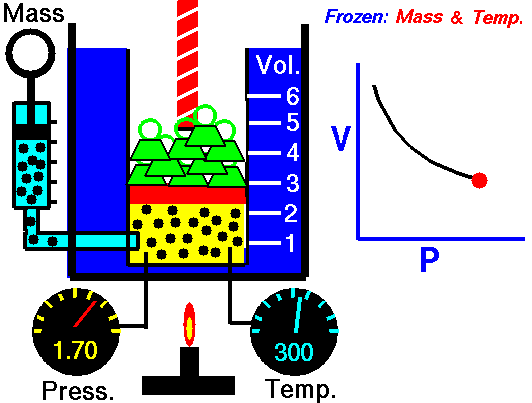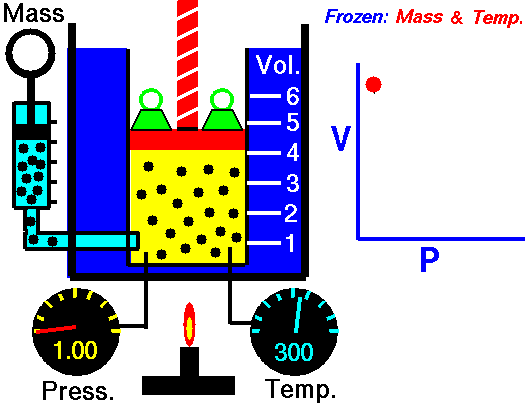
La descripción del comportamiento de los gases en función de su presión, volumen y temperatura obedece a la llamada leyes de los gases, que confirman que dicha magnitudes están relacionada entre si y que coinciden con los resultados de la teoría cinética de los gases. Consideremos primero la relación existente entre el volumen y la presión de un gas, dicha relación se expresa mediante la ley de Byle-Mariotte, que afirman para una temperatura constante, la presión ejercida por una masa de gas sobre las paredes del recipiente, que la contiene es inversamente proporcional al volumen, que dicho gas ocupa.
La ley expresa como P.V= constante, para una temperatura determinada, donde P es la presión y V representa el volumen, desde punto de vista de la teoría cinética de los gases, esta ley es correcta, ya que al reducirse el volumen, que ocupa un gas a temperatura constante, los átomos o moléculas, que lo componen deben chocar con mayor frecuencia con las paredes, por lo que ha de aumentar la presión.
La relación entre el volumen y la temperatura viene dada por la primera ley de Gay-Lussac, que afirma que para una presión, que se mantenga constante, existe una proporcionalidad entre el volumen que ocupa el gas y su temperatura, en donde la relación es V/T= constante, donde V es el volumen y T es la temperatura absoluta, por este motivo también esta teoría es aceptable, ya que el aumento de la temperatura, hace que aumente la energía de los átomos o partículas. Dicho aumento debe traducirse en una mayor velocidad y choque más fuertes con las paredes del recipiente, ya que es necesario que aumente el volumen.
Fuente Bibliográfica
Física general - Página 268 por Santiago Burbano de Ercilla, Carlos Gracia Muñoz - 2003.
Química general. Introducción a la Química Teórica - Página 257 por Cristóbal Valenzuela Calahorro - 1995.

