Badania nad najbardziej rozpowszechnionym związkiem na ziemi sięgają wiele lat wstecz. W pierwszym tysiącleciu przed naszą erą Tales z Miletu stwierdził, że: „początkiem wszechrzeczy jest woda” i miał on sporo racji. Woda ma wiele znamiennych właściwości zarówno psychicznych i fizycznych a spośród nich wiele jest anomalnych.
Czym jest anomalna ciecz?
Anomalną ciecz można zdefiniować jako jednoskładnikową substancję, która w stanie ciekłym zachowuje się inaczej niż inne argonopodobne ciecze. W przypadku wody, anomalne właściwości są wynikiem unikalnych cech indywidualnych cząsteczek wody oraz mają bezpośredni związek z obecnością rozległej sieci wiązań wodorowych.
1) Nietypowo wysoka temperatura topnienia i wrzenia.
1.1. Woda – struktura cząsteczki
Jeżeli rozważymy atomowe składowe wody, możemy wysnuć wniosek, że woda w warunkach normalnych jest gazem. Ponadto, w stanie ciekłym powinna znajdować się w zakresie temperatur -80˚C oraz -110˚C, a nie 0˚C oraz +100˚C jak jest w rzeczywistości. Zwłaszcza przy porównaniu z jej cięższymi analogami z tej samej grupy układu okresowego: siarką, selenem i tellurem.

1.2. Porównanie z innymi wodorkami.
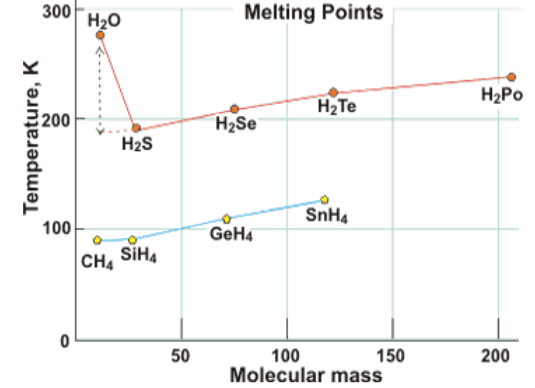
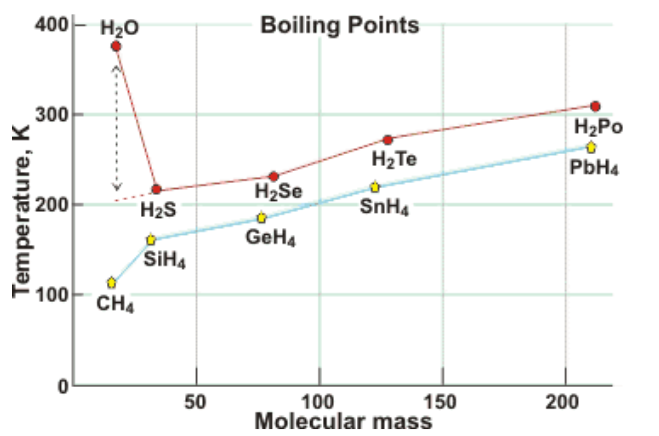
Temperatura topnienia/ wrzenia w wodorkach siarki/ selenu/ telluru wynosi kolejno -82°C/-60°C; -65,73°C/-41,25°C i -49°C/-2,2°C. Woda jako lekka molekuła (masa atomowa = 18) powinna potrzebować do osiągnięcia wrzenia znacznie mniej energii niż H2S (34), H2Se (81), H2Te (130). Zamiast tego, temperatura wrzenia wody jest ponad 150 K wyższa niż moglibyśmy przypuszczać podczas naszych teoretycznych rozważań. Tak samo temperatura topnienia jest ponad 100 K wyższa niż wynika z ekstrapolacji podczas porównania wody z innymi wodorkami grupy 6.
1.3. Wyjaśnienie
Anomalnie wysokie temperatury topnienia i wrzenia wody mogą być wyjaśnione przez silne powiązania pomiędzy cząsteczkami wody tzw. wiązania lub mostki wodorowe. Nawet pomimo faktu, że najbardziej rozpowszechnione wiązania wodorowe są dużo słabsze od wiązań kowalencyjnych to aby stopić albo zagotować wodę musimy zerwać wiele z nich. Aby to osiągnąć potrzeba dużo energii.
Tab. 1 Temperatury wrzenia i topnienia oraz energie wiązania wodorowego dla kilku cieczy.
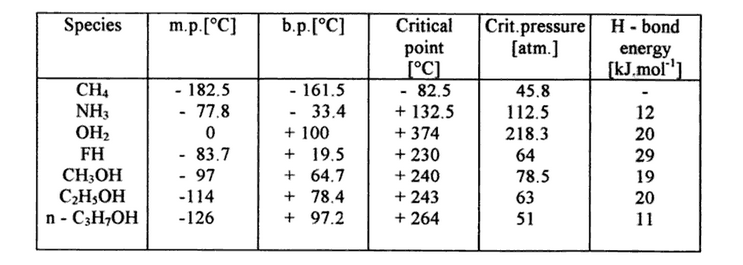
Ale przecież wiemy, że wiązanie wodorowe występują nie tylko w wodzie. Jeżeli przyjrzymy się ciekłemu wodorkowi fluoru to zauważymy, że występujące tam wiązania wodorowe są dużo silniejsze od tych istniejących w wodzie. Skoro tak, dlaczego temperatura wrzenia i topnienia wodorku fluoru jest tak niska?
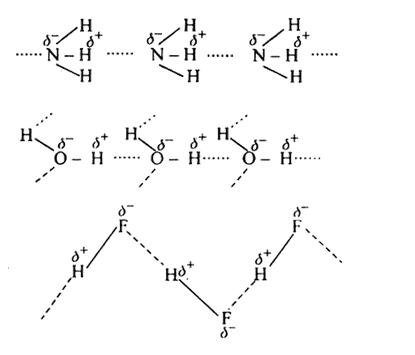
Kluczową w tym przypadku różnicą występującą pomiędzy ciekłą wodą a ciekłym HF jest różne uporządkowanie cząsteczek w przestrzeni. Wodorek fluoru ma trzy wolne pary elektronowe na atomie fluoru ale tylko jeden atom wodoru- przez to, może tworzyć jedynie dwa wiązania wodorowe (jednowymiarowe łańcuchy). Woda z kolei, może tworzyć aż cztery wiązania wodorowe. Prowadzi do to utworzenia niezwykle silnej, ale i elastycznej trójwymiarowej sieci.