Proteínas:
son macromoléculas importantes, constituyen el 50 % del peso seco de la mayoría de las células y con una estructura compleja que tienen múltiples funciones:
• Estructurales (soporte)
• Defensa
• Señalización (comunicación celular)
• Almacenamiento (energía, nutrientes)
• Transporte (sustancias)
• Reguladoras (reacciones químicas)
• catalíticas
Las proteínas se sintetizan de manera exclusiva a partir de 20 l alfa aminoácidos codificados por tripletes de nucleótidos llamados codones.
Aminoácidos: los L alfa aminoácidos satisfacen funciones metabólicas vitales, además de servir de bloques para la construcción de proteínas.
Las moléculas que tienen las mismas cargas tanto positivas como negativas o sea son moléculas neutralizadas se denominan Zwiteriones.
Los aminoácidos esenciales son aquellos que el cuerpo no puede sintetizar de forma natural y necesita ser suministrado en los alimentos y uno de los mas importantes es la arginina que se involucra mucho en el crecimiento y formación de tejidos.
Los aminoácidos no esenciales son aquellos que el cuerpo puede sintetizar a partir de carbohidratos y lípidos sin necesidad de ser suministrados desde afuera, pero son de igual importancia que los esenciales.

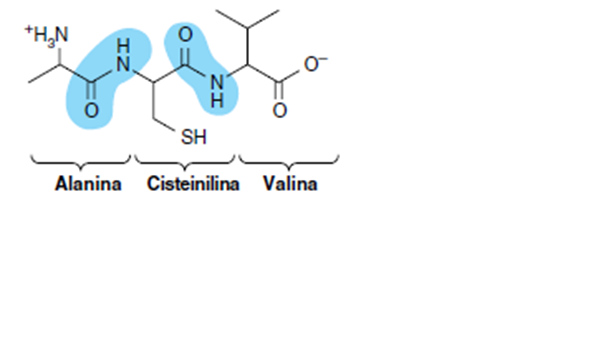
Los aminoácidos están entrelazados entre sí por enlaces peptídicos
Los aminoácidos poseen dos grupos funcionales Carboxilo y Amino con un carbono central llamado carbono alfa el cual esta unido a los 2 grupos funcionales, un átomo de H y una cadena R y según la naturaleza de la cadena R el amino acido es clasificado en hidrofílico o Hidrofóbico.

Los péptidos son polímeros de residuos de aminoácidos, el numero y el orden de los aminoácidos en un polipéptido constituyen su estructura primaria. Los aminoácidos presentes en péptidos se llaman residuos de aminoacilos y se refieren a ellos cambiando el “ato” y el “ina” por “il”
El grupo amino de un aminoácido se une al grupo carboxilo de otro, por la acción de una enzima en una acción deshidratante, esta unión covalente es conocida como enlace peptídico
Oligopéptidos
2 a 10
Aminoácidos
polipeptidos
10 a 100
Aminoácidos
Proteinas
100 o mas
Aminoácidos
Niveles estructurales de las proteínas
Primaria: lineal resulta de la unión de los aminoácidos con dos uniones covalentes de acuerdo a la información del código genético.
Secundaria: la conforman dos hélices enrolladas entre si con puentes de hidrogeno a intervalos regulares una hélice es alfa y la otra beta.
Terciaria: un enrollamiento irregular y desordenado, con plegamientos o hélices que están unidas por puentes de hidrogeno y enlaces iónicos, interacciones hidrofóbicas con fuerzas de van der Walls. Y algunas uniones covalentes fuertes llamadas puentes de disulfuro.
Cuaternaria: algunas proteínas tienen dos o más cadenas de polipéptidos, son proteínas oligomericas, y tienen el mismo enrollamiento irregular. Ejemplo: la hemoglobina tiene 4 cadenas de polipéptidos, el colágeno está formado por 3 subunidades enrolladas de una forma muy similar a una soga muy fuerte.
Desnaturalización de las proteínas
Las cadenas polipéptidos pueden enrollarse y plegarse espontáneamente para formar su estructura tridimensional definitiva que le da su funcionalidad. Esto ocurre cuando se produce la síntesis de la proteína en la célula, aunque siempre bajo ciertas condiciones fisicoquímicas especiales de su medio ambiente:
• pH
• Temperatura
• Concentración de sales
Cuando estas condiciones no son óptimas la conformación funcional de la macromolécula cambia y se altera su funcionamiento esto se llama desnaturalización, este proceso puede ser tanto reversible como irreversible.
Enzimas
Son proteínas que regulan, controlan, aceleran y al final hacen posibles las reacciones químicas, optimizando el gasto energético.
(Las reacciones pueden ser tanto endergónicas como exergónicas y liberadoras de energía como la degradación de la glucosa)
• Tienen gran potencia catalítica
• Solo reconocen a su sustrato especifico
Su nomenclatura lleva el sufijo “asa” al sustrato que cataliza
Se clasifican por el tipo de reacción:
• Oxidorreductasas: catalizan oxidaciones y reducciones
• Transferasas: catalizan la trasferencia de porciones, como grupos glucósidos, metilo y fosforilo.
• Hidrolasas: catalizan la división hidrolítica de C-C , C-O , C-N y otros enlaces.
• Liasas: catalizan las divisiones de C-C , C-O , C-N y otros enlaces covalentes mediante eliminación de átomos dejando dobles enlaces.
• Isomerasas catalizan cambios geométricos y estructurales dentro de una molecula
• Ligasas: catalizan la unión de dos moléculas en reacciones acopladas a la hidrolisis de ATP
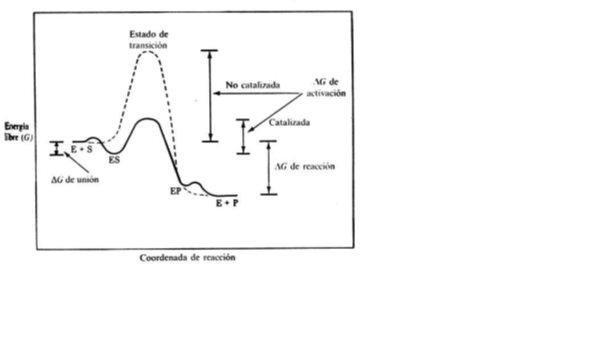
la enzima acelera la reacción disminuyendo la energía de activación permitiendo un gran ahorro energetico.
Ciertas enzimas necesitan de un factor adicional para que se active, estas enzimas activas se denominan holoenzimas y están formadas por una proteína sin actividad llamada apoenzima y un cofactor enzimático.
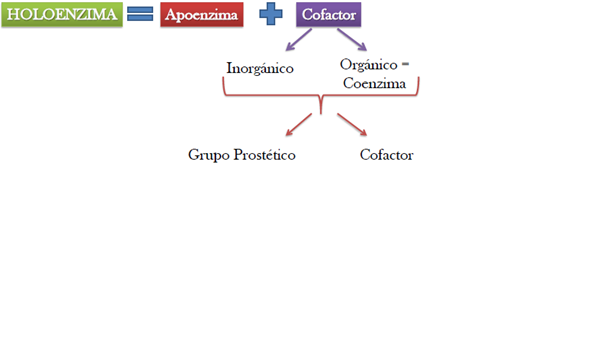
Cofactores importantes

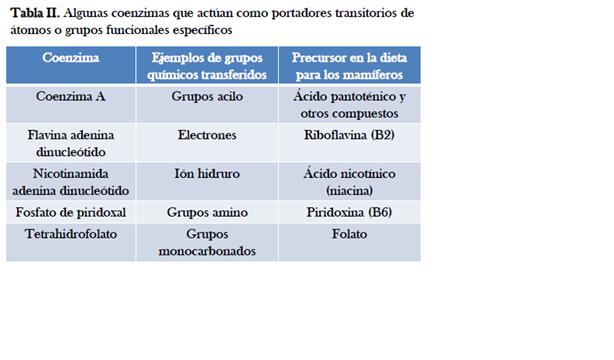
Coenzimas
Factores que afectan la velocidad de una reacción catalizada por enzimas
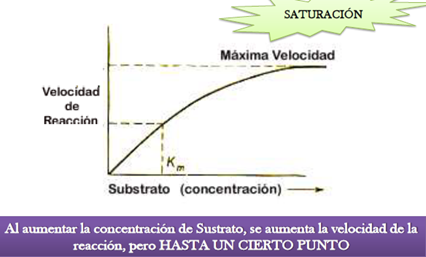
1 concentración de sustrato: al inicio de la reacción la cantidad se sustrato es optima y la enzima cataliza en su máximo potencial pero a medida que el sustrato disminuye va reduciendo la velocidad de formación del producto y en este momento la reacción llega a su equilibrio.
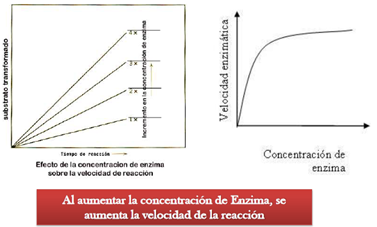
2 concentración de enzima
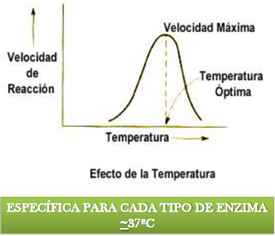
3 temperatura: el aumento de la temperatura puede acelerar la acción enzimática pero solo hasta cierto punto es optimo. Si aumenta más la acción enzimática decaerá rápidamente. Porque las moléculas comienzan a romperse y la molécula proteica se desnaturaliza.
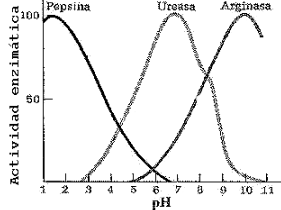
4 pH: del mismo modo que pasa con la temperatura, el pH debe estar siempre en un estado optimo debido a que una variación puede modificar la naturaleza de los grupos químicos ionizables de las enzimas, desnaturalizándola, y puede causar los mismo en los sustratos.
 ng)
ng)
Carbohidratos
Son compuestos orgánicos que tienen carbono; hidrogeno y oxigeno incluyen azucares y sus polímeros son unas de las moléculas mas importantes como combustible y material de construcción.
Son polihidroxialdeidos o polihidroxicetonas
Monosacáridos
Azúcar simple
Glucosa
Oligosacáridos
2 a 19
Monosacáridos
Poligosacaridos
Mas de 20
Monosacáridos
Los monosacáridos son solubles en solventes polares e insolubles en solventes polares
Unidos por enlaces glucosídicos forman oligosacáridos y poligosacaridos.
Lípidos
Moléculas no polares hidrofóbicas, grandes no forman polímeros y sus componentes se asociar espontáneamente formando macromoléculas, una de sus funciones mas importantes es el almacenamiento de grandes cantidades de energía.
Clasificación
Lípidos simples
• Esteroides
• Terpenoides
• Ácidos grasos
• Prostaglandinas
Lípidos compuestos
• Esfingolípidos
• Fosfolípidos
• Acilglicéridos
• Ceras
Lípidos derivados
• Esteroides
• Carotenoides
• Leucotrienos
• Prostaglandinas
• Tromboxanos
Buen post, ya voy a repasar un poco. Aquí una memotecnia para aminoácidos esenciales:
Fer Hizo un Lio Tremendo y Valentina Le Metió un Triptófano