When the fundamentals of biochemistry are presented, it is possible to explain, in a simple way, the relationship of the physical properties of organic compounds with respect to their molecular structures, in terms of the freezing point that differs from the boiling point. Both concepts have their own characteristics and physical conditions that require a biochemical process to develop.
Cuando se exponen los fundamentos de la bioquímica es posible explicar, de forma sencilla, la relación de las propiedades físicas de los compuestos orgánicos con respecto a sus estructuras moleculares, en cuanto al punto de congelación que difiere del punto de ebullición. Ambos conceptos poseen sus propias características y condiciones físicas que disponen de un proceso bioquímico para desarrollarse.

Ice cubes Bag with ice cubes y Boiling water
Hielo en cubos Bolsa con cubitos de hielo y Agua Hirviendo
If a container with water is placed inside a refrigerator (freezer), it reduces its energy, according to its density, the molecules lose heat and stop moving, thus causing the freezing point.
Sí se coloca un envase con agua dentro de un refrigerador (congelador), ésta reduce su energía, según su densidad, las moléculas pierden calor y dejan de moverse, ahí se origina el punto de congelación.
When a container with water is placed on the fire, as the fire is at a higher temperature than the water, it transfers heat to it; thus the temperature in the water increases progressively, which can be checked by placing a thermometer in the water. When the water reaches 100ºC, it boils, begins to flow bubbles, becoming water vapor (boiling point), and stops increasing its temperature, despite the fact that the fire continues to supply it with heat. When going from liquid water to water vapor, all the heat is used to transform the liquid to gas, without changing the temperature.
Al colocar sobre el fuego un recipiente con agua, como el fuego está a mayor temperatura que el agua, le traspasa calor; así la temperatura en el agua aumenta progresivamente, lo que se puede comprobar al colocar un termómetro en el agua. Al llegar el agua a 100ºC, hierve, empieza a fluir burbujas, convirtiéndose en vapor de agua (punto de ebullición), y deja de aumentar su temperatura, pese a que el fuego sigue suministrándole calor. Al pasar de agua líquida a vapor de agua, todo el calor se usa en transformar el líquido a gas, sin variar la temperatura.
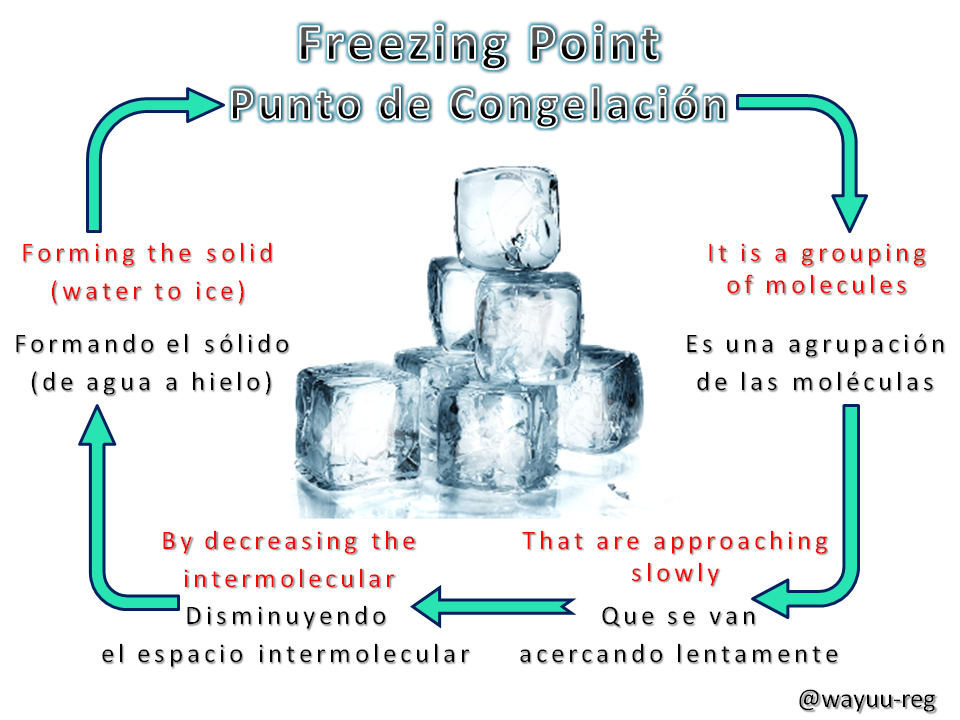
Freeze Point
Punto de Congelación
“The freezing point of a liquid is the temperature at which the liquid solidifies due to a reduction in energy. The freezing point varies depending on the density of the liquid…” ✱ Freeze Point
“El punto de congelación de un líquido es la temperatura a la que dicho líquido se solidifica debido a una reducción de energía. El punto de congelación varía dependiendo de la densidad del líquido…” ✱ Punto de Congelación
Public domain image (CC0): Ice cubes
republished in PowerPoint as PNG image
Imagen de dominio público (CC0): Cubitos de Hielo
reeditada en PowerPoint como imagen PNG
“It is reached in a solution when the kinetic energy of the molecules becomes lower as the temperature decreases; increased intermolecular forces of attraction and decreased kinetic energy cause liquids to crystallize. Solutions always freeze at a lower temperature than the pure solvent. The freezing temperature of pure water is 0 °C…” ✱ Freeze Point
“…Se alcanza en una solución cuando la energía cinética de las moléculas se hace menor a medida que la temperatura disminuye; el aumento de las fuerzas intermoleculares de atracción y el descenso de la energía cinética son las causas de que los líquidos cristalicen. Las soluciones siempre se congelan a menor temperatura que el disolvente puro. La temperatura de congelación del agua pura es 0 °C…” ✱ Punto de Congelación
Liquids become solids by the removal of heat. As the temperature is lowered, the molecules in the liquid move more slowly. If the temperature is lowered sufficiently so that the forces of attraction cause the slower moving molecules to become completely immobile, the liquid begins to freeze. If the molecules are “frozen” in a well-ordered lattice, a crystalline solid is formed, whereas if the molecules are frozen in a disordered manner, an amorphous solid is produced. As a solid forms, the kinetic energy of the remaining molecules in the liquid increases. This is because the solid has lost the molecules with low kinetic energy. Therefore, for freezing to continue, heat must be continuously removed.
Los líquidos se vuelven sólidos por la eliminación del calor. A medida que se abate la temperatura, las moléculas en el líquido se mueven más lentamente. Sí la temperatura disminuye lo suficiente, de manera que las fuerzas de atracción hagan que las moléculas que tienen movimiento más lento lleguen a mantenerse completamente inmóviles, el líquido comienza a congelarse. Sí las moléculas están “congeladas” en una red bien ordenada, se forma un sólido cristalino, mediante que, si las moléculas se congelan de manera desordenada, se produce un sólido amorfo. A medida que se forma un sólido, la energía cinética de las moléculas restantes en el líquido, aumenta. Esto se debe a que el sólido ha perdido las moléculas con baja energía cinética. Por lo tanto, para que la congelación continúe se deberá eliminar calor continuamente.
In a solid, as in a liquid, you have a kinetic energy distribution. When a solid is in contact with a liquid, high-energy molecules can escape from the solid into the liquid state. At a certain temperature called the freezing point or melting point, the rate at which the molecules leave the solid to enter the liquid is the same as the rate at which the molecules are leaving the liquid state to become part of the solid. Thus, at the melting point of a solid or the freezing point of a liquid, there is equilibrium between the solid and the liquid.
En un sólido, lo mismo que en un líquido, se tiene una distribución de energía cinética. Cuando un sólido está en contacto con un líquido, las moléculas de alta energía pueden escapar del sólido y pasar al estado líquido. A una temperatura determinada llamada punto de congelación o punto de fusión; la velocidad con la que las moléculas dejan al sólido para entrar en el líquido, es la misma que la velocidad a la cual las moléculas están dejando el estado líquido para convertirse en parte del sólido. De esta manera, en el punto de fusión de un sólido o el punto de congelación der un líquido, existe equilibrio entre el sólido y el líquido.
The total amount of heat that must be removed to freeze one mol of a liquid is called the molar heat of crystallization. On the other hand, the molar heat of fusion, Hfus, is equal in magnitude but opposite in sign to the molar heat of crystallization and is defined as the amount of heat that must be supplied to melt one mole of a solid. Since heat must be added to melt a solid, the forces of attraction must be slightly greater in a solid than in a liquid. This is not surprising, since it is expected that to hold the particles firmly in place in the solid, stronger attractive forces are needed to hold them in place in the liquid, where they are free to move.
La cantidad total de calor que se debe eliminar para congelar un mol de un líquido, se llama calor molar de cristalización. Por otra parte, el calor molar de fusión, Hfus, es igual en magnitud, pero de signo opuesto al calor molar de cristalización y se define como la cantidad de calor que debe suministrarse para fundir un mol de un sólido. Ya que para fundir un sólido debe agregarse calor, las fuerzas de atracción deben ser ligeramente más grandes en un sólido que en un líquido. Esto no es sorprendente, debido a que se espera que para sostener firmemente a las partículas en su lugar en el sólido, se necesitan fuerzas de atracción más intensas de las que se requieren para mantenerlas dentro del líquido, donde son libres para moverse.
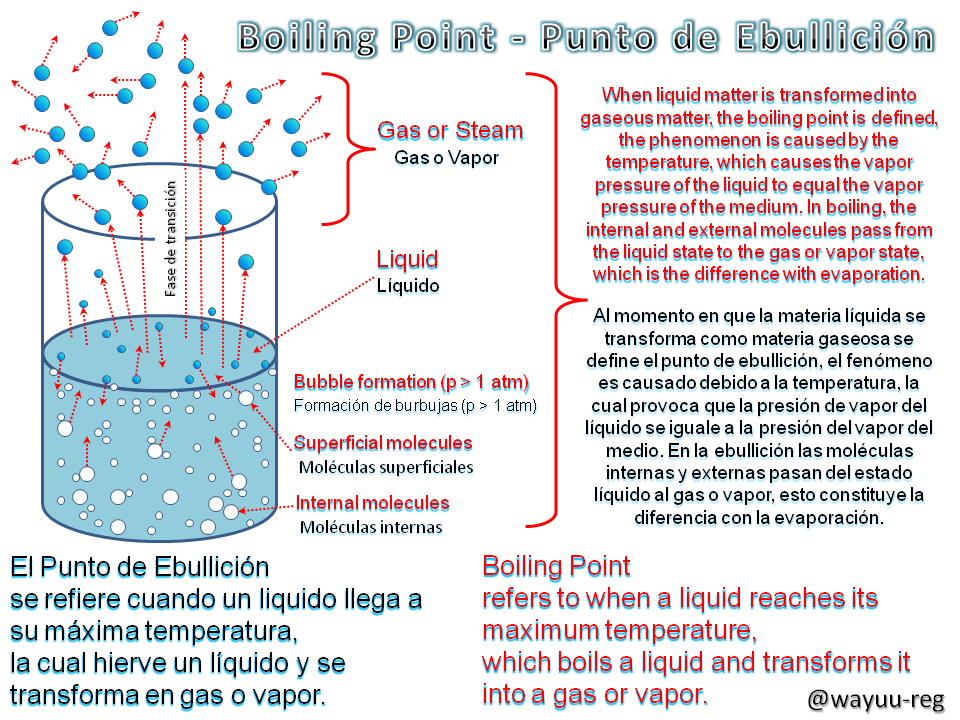
Boiling Point
Punto de Ebullición
Boiling is a particular case of vaporization; it consists of the passage of a liquid to the vapor state with the formation of bubbles when the liquid is in an open vessel.
La ebullición es un caso particular de la vaporización; consiste en el paso de un líquido al estado de vapor con formación de burbujas, estando dicho líquido en una vasija abierta.
at which a liquid begins to boil
Image of my authorship, edited in PowerPoint
a la que un líquido comienza a hervir
Imagen de mi autoría, editada en PowerPoint
“The boiling point of a substance is the temperature at which the vapor pressure of the liquid is equal to the pressure surrounding the liquid and transforms into vapor…” ✱ Boiling Point
“El punto de ebullición de una sustancia es la temperatura a la cual la presión de vapor del líquido es igual a la presión que rodea al líquido y se transforma en vapor…” ✱Punto de Ebullición
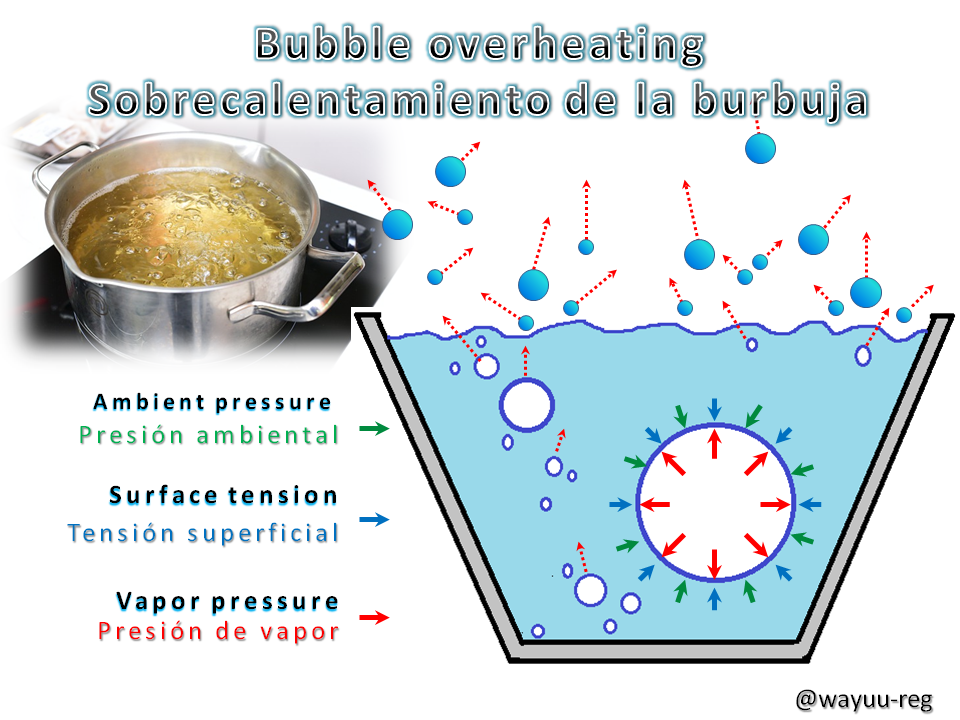
Image republished in PowerPoint
Public domain (CC0): Boil water to boiling point
Imagen reeditada en PowerPoint
Dominio público (CC0): Hervir agua a punto de ebullición
“…a liquid's boiling point varies with the ambient pressure surrounding it. A liquid in a partial vacuum has a lower boiling point than when that liquid is at atmospheric pressure. A liquid at high pressure has a higher boiling point than when that liquid is at atmospheric pressure…” ✱Boiling Point
“…un punto de ebullición de un líquido varía según la presión ambiental que lo rodea. Un líquido en un vacío parcial tiene un punto de ebullición más bajo que cuando ese líquido está a la presión atmosférica. Un líquido a alta presión tiene un punto de ebullición más alto que cuando ese líquido está a la presión atmosférica…” ✱Punto de Ebullición
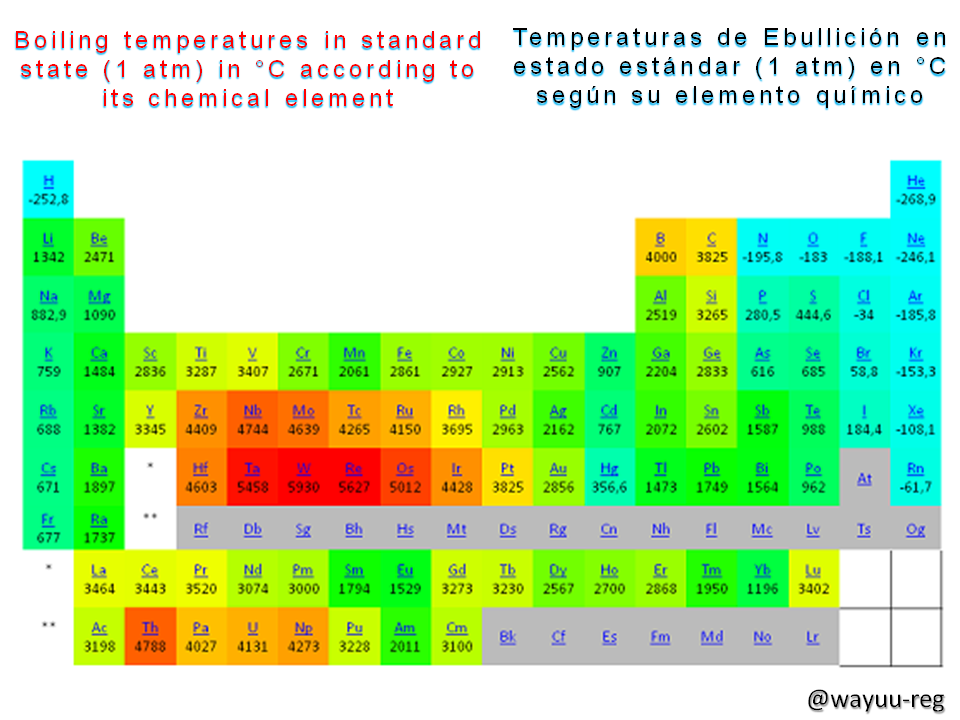
The boiling point of a liquid depends on the pressure; when the pressure is 700 mm/Hg, water boils at 97.7 °C, while if it is 760 mm/Hg, it boils at 100°C.
El punto de ebullición de un líquido depende de la presión; cuando ésta es de 700 mm/Hg, el agua hierve a la 97,7 °C, mientras que sí es de 760 mm/Hg, lo hace a 100°C.
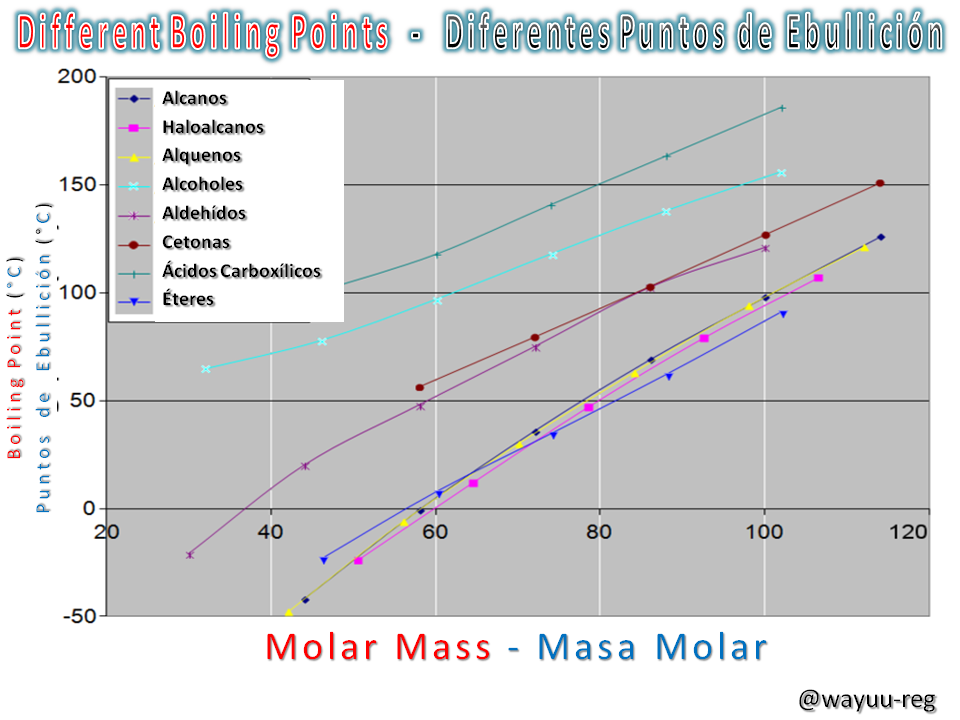
of alkanes, alkenes, ethers, haloalkanes, aldehydes, ketones, alcohols and carboxylic acids as a function of their molar mass. The curves show approximately the same gradient. In all cases, boiling points of straight-chain compounds are used.
de alcanos, alquenos, éteres, haloalcanos, aldehídos, cetonas, alcoholes y ácidos carboxílicos en función de su masa molar. Las curvas exponen aproximadamente el mismo gradiente. En todos los casos, se utilizan puntos de ebullición de compuestos de cadena lineal.
The normal boiling point is defined as the temperature at which the vapor pressure of a liquid is equal to the normal atmospheric pressure; this is equal to 760 mm/Hg. In a certain way, the term "boiling point" is almost always used to refer to the normal or standard state, where the atmospheric pressure should be 1013.25 hPa
El punto de ebullición normal se define como la temperatura a la cual la presión de vapor de un líquido es igual a la presión atmosférica normal; esto es igual 760 mm/Hg. De cierta manera, casi siempre se utiliza el término “punto de ebullición” refiriéndose al estado normal o estándar, en donde la presión de la atmosfera debe estar en 1013,25 hPa
Original file by David R. Lide (2009) "CRC Handbook of Chemistry and Physics" (90th English edition) Boca Raton CRC Press/Taylor and Francis p. 2804 (ISBN 9781420090840)
Archivo original de David R. Lide (2009) “CRC Handbook of Chemistry and Physics” (90 edición en ingles) Boca Raton CRC Press/Taylor and Francis pág. 2804 (ISBN 9781420090840)
As can be seen in the graph above, the "temperature varies according to the liquid", since this variation is linked to the properties of the chemical element and does not originate from the amount at which the liquid is intended to boil.
Como se puede notar en la gráfica anterior, la “temperatura varía según el líquido”, ya que esta variación es vinculada a las propiedades del elemento químico y no se origina por la cantidad a la cual se intenta hervir dicho líquido.
The temperature is always constant in all liquids, this is called latent heat of evaporation. At the beginning of boiling, it does not vary. If there is any thermal agitation at the time of boiling, the vapor or gas is not only created on the surface, but also throughout the liquid; that is why, during boiling, bubbles originate inside the liquid (the bubbles show the result of the transition from liquid to gas or vapor).
La temperatura, siempre es constante en todo líquido, a esto se le denomina calor latente de evaporación. Al comenzar la ebullición, ésta no varía. Si existe alguna agitación térmica al momento de la ebullición, el vapor o gas no se crea solo en la superficie, también en todo el líquido; es por ello que, en la ebullición se originan burbujas en el interior del líquido (las burbujas muestran el resultado de la transición de líquido a gas o vapor).
The atmospheric pressure existing at the surface of a liquid, is permanently related during the course of the boiling point and to the pressure of the saturated vapor. All these pressures remain identical. If you look at the above graph, the data for each boiling point (according to each liquid), it refers to elements under a normal pressure of 760 mm of mercury. On the other hand, when the boiling point is high or the element is sensitive to heat, its normal pressure is indicated at 10 mm of mercury. By changing the external pressure on the surface of the liquid, the initial boiling point is also changed. Modern technology has made use of this particularity by developing hermetically sealed vessels (pressure cookers), where the compression of the vapor causes very high pressures (overpressure); therefore, the boiling point temperature rises and boils more rapidly than in a normal vessel. Thus, water that boils at a temperature of 2 atmospheres at 100°C normally, boils at 120°C in this situation.
La presión atmosférica existente en la superficie de un líquido guarda relación permanente durante el transcurso del punto de ebullición y con la presión del vapor saturado. Todas estas presiones permanecen idénticas. Sí se observan, en la gráfica anterior, los datos de cada punto de ebullición (según cada líquido), se refiere a elementos que se encuentran bajo una presión normal de 760 mm de mercurio. Por otra parte, cuando el punto de ebullición es elevado o el elemento es sensible al calor, su presión normal se indica a 10 mm de mercurio. Al modificar la presión exterior sobre la superficie del líquido, también se modifica el punto de ebullición inicial. La tecnología moderna ha utilizado esta particularidad, desarrollando recipientes herméticamente cerrados (ollas de presión), en donde la compresión del vapor origina presiones muy elevadas (sobrepresión); por tanto, se eleva la temperatura del punto de ebullición y se hace más rápidamente que en un recipiente normal. Así que, el agua que hierve a una temperatura de 2 atmósferas con 100°C normalmente, pasa a hervir en 120°C bajo esta situación.
Regarding the differences between the boiling point and the freezing point, it can be said that depending on the type of molecule and according to its molecular structure based on the spatial distribution and connectivity of the nuclei, in addition to the number of atoms that constitute the molecule, any modification or alteration in some of these variables would stimulate variation in the chemical, physical and even biological properties of the molecule.
En cuanto a las diferencias entre el punto de ebullición y el punto de congelación, se puede decir que dependiendo del tipo de molécula y según su estructura molecular basada en la distribución espacial y conectividad de los núcleos, además del número de átomos que constituyen la molécula, toda modificación o alteración en algunas de estas variables estimularía la variación en las propiedades químicas, físicas y hasta biológicas de la molécula.
So then, the first difference in terms of the temperature of both "points" is defined. Taking into account the element Water, its freezing point is 0°C (under the Celsius temperature scale); once water reaches the temperature of 100°C (when it is boiling), it is called boiling point, according to the standard atmospheric pressure.
Así entonces, se define la primera diferencia en cuanto a la temperatura de ambos “puntos”. Tomando en cuenta el elemento Agua, su punto de congelación es de 0°C (bajo la escala de temperatura Celsius); una vez que el agua alcance la temperatura de 100°C (cuando está hirviendo), se denomina punto de ebullición, según la presión atmosférica estándar.
Another difference, and taking into account the temperature, the substance transforms from its liquid state to the solid state, is the moment of its alteration where the liquid solidifies by reduction of the temperature. Solutions always freeze. On the other hand, there is the boiling point, which has the characteristic of transforming from the liquid to the gaseous state. Continuing the example with the element water, by increasing its temperature is able to "create bubbles", since its molecules escape from all parts of the compound (mostly to the surface) and throughout the volume of the liquid moves creating imperfections due to the phenomenon of the Surface Tension.
If this water when heated, exceeds the boiling point, it is said that the liquid is overheated, which can generate an explosive boiling. An example of this is the incorrect use of pressure cookers or microwave ovens. Depending on the degree of heat that a liquid retains before boiling, it will depend on the specific chemical nature of the liquid and the weight of the atmosphere exerted on it.
Otra diferencia, y tomando en cuenta a la temperatura, la sustancia se transforma de su estado líquido al estado sólido, es el momento de su alteración en donde el líquido se solidifica por reducción de la temperatura. Las soluciones siempre se congelan. Por otra parte, está el punto de ebullición, que presenta la característica de transformase del estado líquido al estado gaseoso. Siguiendo el ejemplo con el elemento agua, al aumentar su temperatura es capaz de “crear burbujas”, ya que sus moléculas se escapan desde todas partes del compuesto (más que todo a la superficie) y en todo el volumen del líquido se mueve creando imperfecciones debido al fenómeno de la Tensión Superficial.
Sí ésta agua al calentarse, sobrepasa el punto de ebullición, se dice que el líquido está sobrecalentado, lo que puede generar una ebullición explosiva. Un ejemplo de ello, es el uso incorrecto de las ollas de presión o los microondas. Según el grado de calor que retenga un líquido antes de empezar su ebullición, va a depender de la naturaleza química específica al unísono del peso de la atmósfera que ejerce sobre ella.
Thank you very much
for your kind attention !
for your kind attention !
And remember that to donate blood,
is to save many lives
is to save many lives
¡ Muchísimas gracias
por su amable atención !
por su amable atención !
Y recuerde que donar sangre,
es salvar muchas vidas
es salvar muchas vidas
@wayuu-reg

All images in this publication were edited with Paint and PowerPoint as a PNG image.
The GIF image at the end of the publication, with personal photographs, was edited with the online application Picasion.com
The Hive logo was used (CC0)
The translation was made by DeepL
- Freezing point
- Freezing point of water
- Atmospheric pressure on liquid
- Boiling Point
- Physical properties of organic compounds
- What is the boiling point?
I would be very pleased to receive your valuable comments and constructive suggestions on the topic presented,
as they will be considered for the improvement of future publications.
Todas las imágenes de esta publicación fueron editadas con la aplicación Paint y PowerPoint como imagen PNG
La imagen GIF al final de la publicación, con fotografías personales, fue editada con la aplicación en línea Picasion.com
Se utilizó el Logo de Hive.blog (CC0)
La traducción fue realizada por DeepL
- Punto de congelación
- Punto de congelación en el agua
- Presión atmosférica sobre un liquido
- Punto de Ebullición
- Propiedades físicas de los compuestos orgánicos
- ¿Qué es el punto de ebullición?
Me sentiría muy complacida en recibir su valioso comentario y constructivas sugerencias acerca del tema presentado,
las cuales serán consideradas para el mejoramiento de las futuras publicaciones.