Bonsoir tout le monde ! ça fait longtemps depuis mon dernier article, cet été j'étais très occupé entre familles, amis et boulot. En plus, j'ai créé mon propre site web pour partager mes articles en dehors de steemit et une nouvelle page Facebook, donc comme vous voyez j'ai beaucoup de travail à faire. Si vous avez du temps, jetez un coup d'oeil et aidez-moi par votre remarques franches (merci d'avance). Aujourd'hui on va aborder un sujet un peu délicat concernant un phénomène grave qui ne cesse pas d'augmenter de fréquence ces dernières années: la résistance bactérienne.
Si je vous pose la question quelle est la découverte la plus importante dans l’histoire de la médecine, que pensez-vous ? La réponse est subjective et variable selon la personne. Mais pour moi c’est sûrement la découverte des antibiotiques. Ces molécules magiques qui agissent sur les bactéries en les détruisant par des mécanismes différents. Yersinia Pestis est une bactérie qui cause la peste noire chez l’homme. Elle a contribué à l’élimination de millions des Européens dans une pandémie historique au milieu du XIVe siècle. En réalité, cette bactérie monstrueuse est très sensible devant les antibiotiques disponibles aujourd’hui.
Pour comprendre l’importance de cette découverte, imaginez un monde sans antibiotiques. Une simple infection bactérienne genre otite ou bien pharyngite (maux de gorge) serait capable de vous tuer.
L’histoire des antibiotiques:
Un antibiotique (du grec anti : « contre », et bios: « la vie ») est toute substance naturelle ou synthétique capable de détruire ou bloquer la croissance des bactéries. Dans le premier cas, on parle d’antibiotique bactéricide et dans le second cas d’antibiotique bactériostatique.
Contrairement à ce que la majorité des gens pense, l’utilisation des antibiotiques date depuis plusieurs décennies. La médecine alternative qui utilise les herbes à but curatif contient des substances actives contre les bactéries, mais il faudra attendre 1889 pour voir utiliser la première fois le terme antibiotique par Vuillemin, un mycologue français.
La vraie révolution a commencé avec le fameux Alexander Fleming qui a découvert théoriquement le premier antibiotique par hasard lors d’une recherche sur les staphylococcus en 1923. Il a remarqué une destruction massive des colonies lorsqu’un champignon a colonisé des boîtes de culture dont il a trouvé sa cause. C’était une enzyme sécrétée par le champignon: La pénicilline. Sir Fleming finissait par avoir un prix Nobel pour sa découverte fascinante en 1945. Au bout de 40 ans, on a pu trouver plusieurs classes des antibiotiques avec des mécanismes d’actions différents soit artificiellement par manipulation chimique soit les extraire de produits des êtres vivants à voir les animaux, les bactéries, les champignons, les plantes etc. Les années 1923-1960 constituaient un “Golden Age” pour les sciences médicales et biologiques où beaucoup des vies ont été sauvées grâce à ce don de la nature.
Caractéristiques d’un antibiotique:
Lorsqu’on décide de traiter un patient atteint d’une infection bactérienne quelconque, on doit choisir le bon antibiotique, le plus adéquat pour son cas. Tout d’abord, il faut connaitre que chaque antibiotique ou famille d’antibiotiques possède un spectre théorique, c’est l’ensemble des germes sensibles à son action. Un excellent exemple illustratif est la famille Polymyxines. Elle agit au niveau de la membrane externe des bactéries (peptidoglycane) mais quelques-unes ne possèdent pas de membrane externe à savoir les bactéries gram négatif. Ce qui fait que l’utilisation de cette famille des antibiotiques lors d’une infection par un germe Gram négatif est pratiquement inefficace.
Dans la majorité des cas, un choix probabiliste des antibiotiques suffit pour prescrire un traitement antibactérien car 90% des infections d’un organe sont causées par des germes déjà connus, en plus on prescrit parfois plus qu’un seul antibiotique pour éviter tout échec possible, viser un spectre plus grand et éliminer le maximum des bactéries résistantes.
Dans les infections graves ou si l’état du patient fait peur, on change de tactique. Dans ce cas, pour déterminer si une bactérie est résistante ou sensible à un antibiotique X, il faut réaliser un antibiogramme sur un échantillon prélevé du patient.
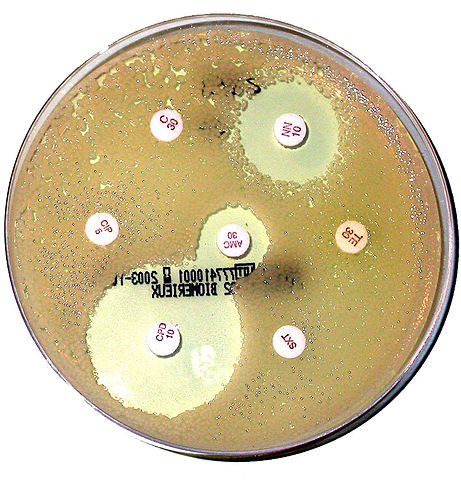
Dans cette image, remarquez la présence des pastilles blanches imbibées par des types différents d’antibiotiques. Les produits seront diffusés dans la gélose de la boîte de culture riche en germes étudiés, plus on est proche de la pastille, plus le produit est concentré. Les cercles blancs sont le résultat de l’absence des germes.
Le diamètre du cercle définit la concentration minimale inhibitrice (CMI). C’est la quantité minimale d’antibiotique capable d’inhiber une multiplication bactérienne. Ce paramètre est très important pour préciser le spectre d’un antibiotique et tester une éventuelle résistance/sensibilité d’un germe. Un autre paramètre qui peut-être calculé est la concentration minimale bactéricide (CMB). Comme son nom l’indique, c’est la plus faible concentration capable de tuer une bactérie. Plus cette concentration est faible plus, l’antibiotique est fort et efficace.
Il existe une relation entre ces deux paramètres, le rapport CMB/CMI permet de prédire le niveau de résistance ou bien de sensibilité d’un germe face à un antibiotique. Si ce rapport est 1 ou 2, l’antibiotique est généralement considéré comme bactéricide, s’il est plus élevé (>3) cet antibiotique est plutôt bactériostatique. Les autres paramètres à prendre en considération avant de prescrire sont les propriétés pharmacocinétiques comme le mode d’administration, la demi-vie, la voie d’élimination, l’index thérapeutique, l’interaction avec les autres médicaments, les effets indésirables etc…
Voici un article précèdent, où j’ai expliqué beaucoup des notions pharmaceutiques, je vous conseille de jetter un coup d’oeil pour plus d’informations !
On prend des exemples typiques: les bêta-lactamines constituent une famille d’antibiotiques célèbre qui possède un index thérapeutique très élevé donc l’intoxication est assez rare et on peut utiliser des doses élevées (plusieurs grammes par jour) pour traiter un malade. Un autre exemple est la famille aminosides, les antibiotiques de cette famille sont administrés en intraveineuse puisqu’ils ne traversent pas la barrière digestive et ils sont éliminés par le rein sous forme active, par conséquent les concentrations de ces antibiotiques sont impressionnantes dans le parenchyme rénal et on peut les utiliser comme traitements des infections urinaires. Comme vous voyez, c’est un vrai clavaire de choisir un antibiotique surtout pour un médecin qui manque d’expérience (comme moi :p). Il faut faire attention et éviter l’automédication à tout prix!
Mécanismes de résistance aux différentes familles d’antibiotiques
La résistance aux antibiotiques est le facteur principal responsable des échecs thérapeutiques, elle peut être naturelle et définit le spectre d’un antibiotique dont on a déjà parlé ou bien acquis par plusieurs mécanismes connus par les chercheurs et des autres mystérieuses. On va prendre quelques exemples utiles pour comprendre ce phénomène mais sachez qu’on va seulement se concentrer sur certains antibiotiques car ily a des dizaines !
Les béta-lactamines
Tous les antibiotiques appartenant à cette famille possèdent un noyau béta-lactame.
Cette famille est constituée par la pénicilline et ses dérivés (Pénicilline G et M, Céphalosporines, les carbapénèmes…). Ils agissent par inhibition terminale de la synthèse d’une partie externe de la paroi cellulaire de la bactérie appelée le peptidoglycane, spécifique aux bactéries Gram + mais on le trouve aussi dans les bactéries Gram – en faibles quantités.
La pénicilline traverse la paroi cellulaire et se fixe sur des protéines attachées à la membrane cellulaire appelées, penicillin binding protein ou tout simplement les PBPs. Il faut se mettre à l’esprit que la paroi bénéficie d’un recyclage continu, ce qui signifie qu’un manque de synthèse d’un élément fondamental comme le peptidoglycane aboutit à la destruction de la bactérie d’où le caractère bactéricide des bêta-lactamines.
La résistance aux bêta-lactamines est devenue fréquente et on a pu expliquer certains mécanismes derrière cette inefficacité. La majorité des bactéries résistantes sécrètent des enzymes appelées Bêta- lactamases. Elles sont capables d’hydrolyser et inactiver les antibiotiques avant d’atteindre les PBPs. D’autres possèdent des PBPs déjà modifiées génétiquement qui ne fixent pas les molécules des bêta-lactamines, cette modification est généralement à cause d’une mutation spontanée. L’information génétique est stockée soit dans l’ADN chromosomique de la bactérie, soit dans des molécules isolées appelées les plasmides.
Dans le dernier scénario, elle peut être passée en faveur d’autres bactéries ce qui permet de propager la résistance et rendre le médicament encore moins efficace. Ce ne sont pas les seuls mécanismes connus, il y a des auteurs qui mentionnent des modifications de perméabilité cellulaire et des phénomènes de tolérance après un usage excessif mais malgré tout ça, cette famille est fréquemment utilisée et très efficace contre une multitude des pathologies.
Aminosides:
Les aminosides sont des antibiotiques composés par des chaînes glycosidiques (sucres) liées à un groupement amine NH2, ils agissent sur la synthèse protéique des bactéries (exemples des aminosides: gentamycine, sreptomycine etc. ). Au début, les aminosides traversent la membrane cellulaire à travers des transporteurs actifs : les porines. Pour que cette étape se déroule normalement, on a besoin des chaînes de transporteurs d’électrons qui se trouvent chez les organismes aérobies (utilisent l’oxygène pour survivre), ce qui rend les bactéries anaérobies naturellement résistante à l’action des aminosides. Ensuite ils atteignent le cytoplasme de la bactérie et se fixent sur des structures spécifiques appelées les ribosomes. Ce sont des usines cellulaires, ils traduisent les messages apportés par les ARNs et synthèses les protéines nécessaires aux fonctionnements cellulaires. Les aminosides altèrent leurs fonctionnements normaux et détruisent la bactérie comme résultat.
L’acquisition d’une résistance est semblable aux bêta-lactamines, une sécrétion enzymatique par la bactérie peut changer la structure chimique des aminosides et déprime leurs actions. Une mutation génétique ou des gènes plasmidiques acquis peuvent changer les sites de fixation des aminosides sur les ribosomes, bref n’importe quelle modification du cycle normal de l’antibiotique peut donner une résistance !
Autres mécanismes de résistance sont décrits, par exemple il y a des bactéries intracellulaires qui augmentent l’excrétion de certains antibiotiques comme les tétracyclines (concentration diminuée= moins d’efficacité), d’autres bactéries changent les composants de leurs membranes cellulaires pour limiter le passage des antibiotiques. La résistance bactérienne aux antibiotiques est un phénomène multifactoriel et grave qui révèle encore des mystères à résoudre, en fin de compte on parle sur des organismes qui se trouvent depuis le début de vie !
L’émergence des superbactéries ?
C’était un jour ordinaire, Mr Y un homme âgé de 40 ans a été admis dans notre service pour prise en charge d’une infection pulmonaire. Il était thalassémique, c’est une maladie génétique qui donne des globules rouges anormales marquée par un taux faible d’hémoglobine, une protéine structurale qui assure le transport d’oxygène vers les tissus, sa maladie nécessite une transfusion régulière du sang pour maintenir un taux normal d’hémoglobine. Un jour après une séance normale de transfusion, Mr Y a eu des difficultés à respirer, une toux et une fièvre progressive, ce qui l’a ramené à consulter les urgences. Son médecin traitant lui a confirmé une pneumonie, c’est une infection respiratoire basse qui touche les parties inférieures de poumons (les alvéoles), elle est grave mais facilement traitable avec des doses adéquates d’antibiotiques. Il lui a prescrit une bithérapie à base d’un aminoside et bêta-lactamine sans faire un antibiogramme pour gagner du temps, au bout de 3 jours le médecin n’a pas remarqué des signes de rémission, au contraire, l’état du malade a aggravé ! Cette fois-ci, il a demandé un antibiogramme en urgence pour savoir les antibiotiques efficaces contre la bactérie qui a causé sa maladie. 24 heures plus tard, ce résultat est arrivé…

Image pris par un de mes collègues
Ça, c’est la définition d’une superbactérie, une bactérie résistante à tous les antibiotiques testés et disponibles. Elle cause beaucoup de problèmes et le risque de mortalité est extrêmement élevé car il n’y a pas un traitement efficace présent.
Cette image est bien réelle, malheureusement, Mr Y a décédé quelques jours après. Cet échantillon ne représente qu’une fraction négligeable des cas de résistance bactériennes vues quotidiennement dans les hôpitaux, mais quelles sont ses causes ?
La réponse est simple, l’usage irrationnel et fréquent des antibiotiques. Si on expose une bactérie spécifique à un antibiotique pendant une longue durée de temps, elle va développer une résistance, c’est pourquoi les infections nosocomiales (attrapées dans des établissements de santé) sont mille fois plus graves que les infections communautaires. La majorité de germes hospitaliers sont super résistants aux antibiotiques à usage fréquent, donc c’est important d’avoir plusieurs familles d’antibiotiques.La relation entre la fréquence et la résistance est donc bien établie, mais pourquoi l’usage irrationnel est aussi à blâmer ?
Dans nos corps, il y a 10 fois plus des bactéries que des cellules humaines, elles participent à l’homéostasie de l’organisme. Parmi ces bactéries, on trouve des bactéries pathogènes et d’autres bénéfiques, chaque jour il y a une concurrence entre ces deux types de bactéries sur la nourriture pour survivre, ce phénomène empêche indirectement l’émergence des souches agressives. Une fois on élimine les bactéries bénéfiques (non-résistantes) après un usage injustifié des antibiotiques, les bactéries pathogènes résistantes augmentent de fréquence et perturbent l’environnement normal. Plus des résistances = Plus des maladies = plus de mortalités.
Le recours aux antibiotiques dans les problèmes de santé quotidiens (auto-médication) a largement augmenté le taux de résistance, il faut savoir que la majorité des infections quotidiennes sont d’origine virale (grippe, rhume, pharyngite…) et ne nécessite pas de traitement antibiotique. La meilleure solution est visiter le médecin et éviter l’automédication à tout prix (oui, j’insiste encore une fois sur ce point), les médecins ne sont pas des anges aussi car beaucoup de prescriptions d’antibiotiques ne sont pas justifiés. Si on continue sur ce chemin d’ignorance et d’irresponsabilité, le futur est sombre, on ne pourra même pas traiter une simple infection. Selon les dernières nouvelles de l’organisation mondiale de santé (OMS), les superbactéries sont devenus un vrai menace à considérer, beaucoup de chercheurs sont en train de réviser leurs options et fouillent des nouvelles familles d’antibiotiques et il y a des espoirs ! Lisez cet article si vous voulez en savoir plus !
Pour aller plus loin
Mécanismes d’action et de résistance aux antibiotiques en PDF
La résistance aux antibiotiques
Cours de bactériologie générale
La crise de résistance aux antibiotiques, article en anglais
Rejoignez @francostem, un projet communautaire pour promouvoir les sciences, l'ingénierie, les mathématiques et la technologie sur Steemit.




Superbe article très bien expliqué! Je ne connaissais pas en détail les modes d'action des différents antibiotiques et c'est vraiment passionnant! Je savais aussi qu'il y avait des superbactéries résistantes à "presque" tous les antibiotiques, mais là, le résultat de l'antibiogramme de M.Y est impressionnant (et effrayant)!
J'irai lire tes liens un peu plus tard, mais en tout cas, ça fait plaisir de te voir de retour! ;)
Merciii bcp, je suis vraiment reconnaisant ! Les gens ne connaissent pas la gravité de la situation, le recours quotidien aux antibiotiques a donné naissance à cette résistance effrayante et c'est difficile pour une personne qui n'appartient pas à un établissement de santé de prendre la situation au sérieux s'il ne voit pas des gens mourir..
Je crois que de plus en plus de gens en sont conscients, mais malheureusement, encore beaucoup de médecins prescrivent à tort ou à travers. Les gens ne savent pas non plus faire la distinction entre "situation nécessitant des antibio" VS "situation n'en nécessitant pas".
Du coup, entre les médecins qui en prescrivent pour rien et les gens qui ne les prennent pas quand ils ne devraient... on n'est pas sorti de l'auberge!
As a follower of @followforupvotes this post has been randomly selected and upvoted! Enjoy your upvote and have a great day!
That's great ! Thx a lot :))
This post has been voted on by the steemstem curation team and voting trail.
There is more to SteemSTEM than just writing posts, check here for some more tips on being a community member. You can also join our discord here to get to know the rest of the community!
Merci pour ce bel article très instructif et le temps que tu as du y consacrer :)
Avec plaisir :)))