Le fluor (F) est le 13ème élément le plus abondant trouvé dans la croûte terrestre, un élément chimique de la famille des halogènes, Il est sous la forme d'un gaz (Difluor F2) de couleur jaune À température et pression normales, ce gaz a une odeur désagréable et vertigineuse et c'est un gaz toxique avec un impact négatif sur les organismes vivants.
Difluor liquide a -196°C, Wikimedia

- Le fluor est l'élément le plus électronégatif (*) avec une valeur de 3,98, c'est pourquoi il se combine plus facilement avec d'autres éléments que n'importe quelle autre substance; Interagit avec les gaz inertes, forme un acide fort avec l'hydrogène et interagit avec le verre. Il forme des liaisons chimiques très fortes avec les atomes de carbone.
Qu'est-ce que l'électronégativité signifie?
Très brièvement, l'électronégativité est le pouvoir d'attraction des électrons par le noyau.
Qu'est-ce qu'un halogène?
- Les halogènes sont des éléments du dix-septiéme groupe du tableau périodique des éléments: (Chlore (Cl), Fluor (F), Brome (Br), Iode (I), Astatin (At)).
Tableau périodique, Pixabay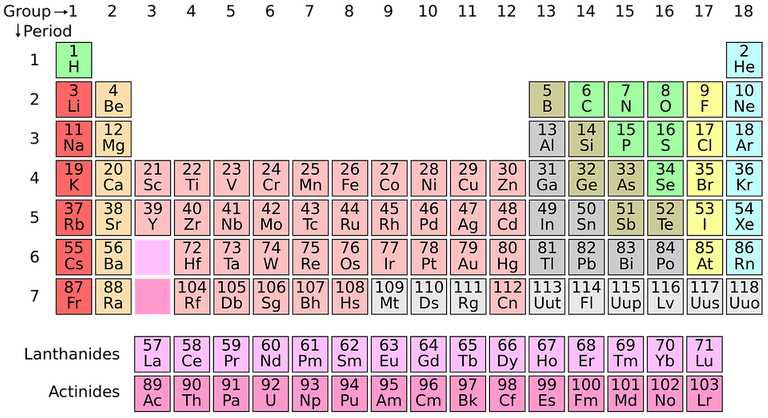
Historique:
- Giorgios Agricola a donné aux fluorites le nom latin "fluorés", qui signifie flux, puis le nom a changé pour le fluorite.
- On a découvert après que la composition de fluorite est le fluorure de calcium CaF2.
- Beaucoup de scientifiques ont échoué les expériences sur le fluor et ses composés au 19ème siècle, et ont été nommés
Les victimes du fluor. - En 1764, Andreas Sigismund Marghergh a décrit en détail le processus de raffinage du verre (traité avec de l'acide) en utilisant de la fluorine avec de l'acide sulfurique.
- Le fluor a été isolé pour la première fois par le scientifique Moissan en 1886.
Photo prise de livre: La géochimie récréative, G.Fresman 1958
Propriétés du fluor:
- Numéro atomique = 9
- Masse atomique: 18,998403 g.mol -1
- Electronégativité selon Pauling: 3,98
- Densité: 1,8 * 10-3 g.cm-3 à 20 ° C
- Point de fusion: -219.6 ° C
- Point d'ébullition: -188 ° C
- Rayon de Vanderwaals: 0.135 nm
- Isotopes: 2
- Energie de première ionisation: 1680.6 kJ.mol -1
- Potentiel standard: - 2,87 V
- L'énergie de liaison dans la molécule F2 est beaucoup plus faible que dans Cl2 ou Br2.
- Le fluor appartient aux oxydants actifs les plus forts.
- Le fluor peut interagir avec la plupart des matériaux.
- Lorsque de petites quantités de fluor réagissent dans l'eau froide, il produit du peroxyde d'hydrogène (eau oxygénée) et de l'acide fluorhydrique:
F2 + 2H2O === H2O2 + 2HF
- Le fluor peut réagir avec tous les éléments chimiques sauf l'hélium et le néon.
- La réaction du fluor avec le xénon et le krypton nécessite des conditions particulières.
- Le fluor se combine avec l'hydrogène pour donner du fluorure d'hydrogène, c'est un gaz toxique.
Le fluor a une grande activité chimique c'est pour sa on ne le trouve qu'en association avec d'autres éléments, telles que: fluorine(CaF2), le fluorapate (Ca5 (PO4) 3F) et le ciroulet (Na3AlF6).
Photo prise de livre: La géochimie récréative, G.Fresman 1958
Préparation en laboratoire:
Pixabay
En 1986, Karl Christie a conçu une méthode de laboratoire pour produire du gaz fluoré avec un bon rendement, selon les équations suivantes:
2 KMnO4 + 2 KF + 10 HF + 3 H2O2 → 2 K2MnF6 + 8 H2O + 3 O20
2 K2MnF6 + 4 SbF5 → 4 KSbF6 + 2 MnF3 + F20
- Moassan a utilisé la méthode de l'électrolyse.
- En raison de sa grande activité, le gaz fluoré produit par l'industrie ou le laboratoire ne peut pas être isolé chimiquement.
Le nickel est utilisé pour la fabrication de vannes et de tuyaux utilisés dans les usines de production du fluor.
Photo prise de livre: La géochimie récréative, G.Fresman 1958
Les réservoirs et bouteilles utilisés pour stocker le fluor sont en acier,ils sont doublés à l'intérieur pour protéger contre la corrosion.
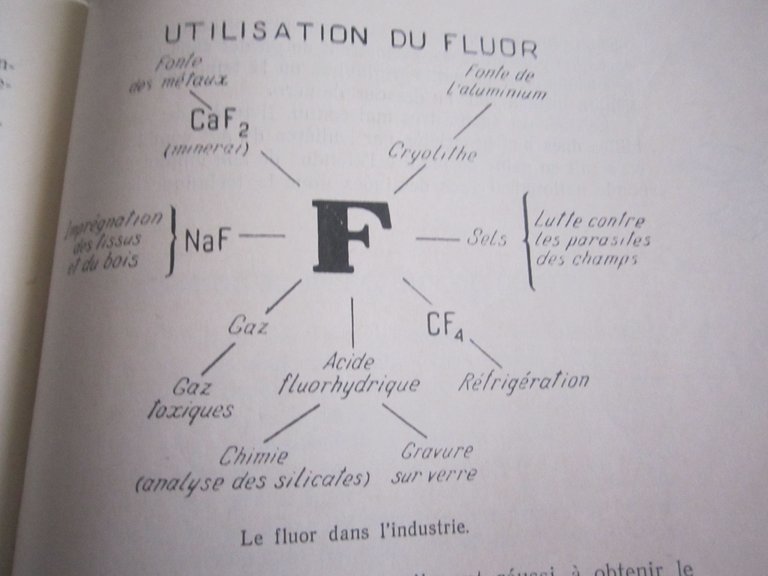
Utilisations industrielles du fluor:
Photo prise de livre: La géochimie récréative, G.Fresman 1958
Le fluor est largement utilisé dans le domaine industriel, avec plus de 17 000 tonnes produites chaque année, et en raison des défis associés à son extraction a cause de sa grande activité, le coût de la production de fluor est considéré un peux cher.
Le fluor est utilisé directement ou indirectement dans de nombreuses industries, notamment: le cycle du combustible nucléaire, production de produits pharmaceutiques fluorés, fonte des métaux, industrie sidérurgique, traitement acide pour le nettoyage des surfaces en acier, développement du verre, fabrication de polymères fluorés, industrie agrochimique, tomographie.......
Top 11 des aliments riches en fluor:
Eau provenant de sources fraîches.
Feuilles de thé
Cornichons.
Jus de raisin.
Épinard.
Produits de tomate.
Carottes.
Du jus d'orange.
Asperges.
Betteraves.
Pruneaux
Comment le fluor est-il apparu dans les eaux souterraines?
En raison de la dissolution des roches contenant du fluor, des concentrations de fluorure (F-) apparaissent dans les eaux souterraines.
- Tellement important:
la concentration maximale acceptable de fluorure dans l'eau potable est de 1,5 mg/l.
Comment le fluorure peut-il protéger les dents?

Pixabay
Le fluor est une substance qui aide à protéger les dents, car elle aide à réduire l'effet des bactéries qui causent les caries dentaires, ceci est ajouté à l'industrie de la pâte dentifrice, et est également ajouté à l'eau potable (0.7 mg/l) dans certains pays.
Le fluorure présente-t-il un danger pour la santé?
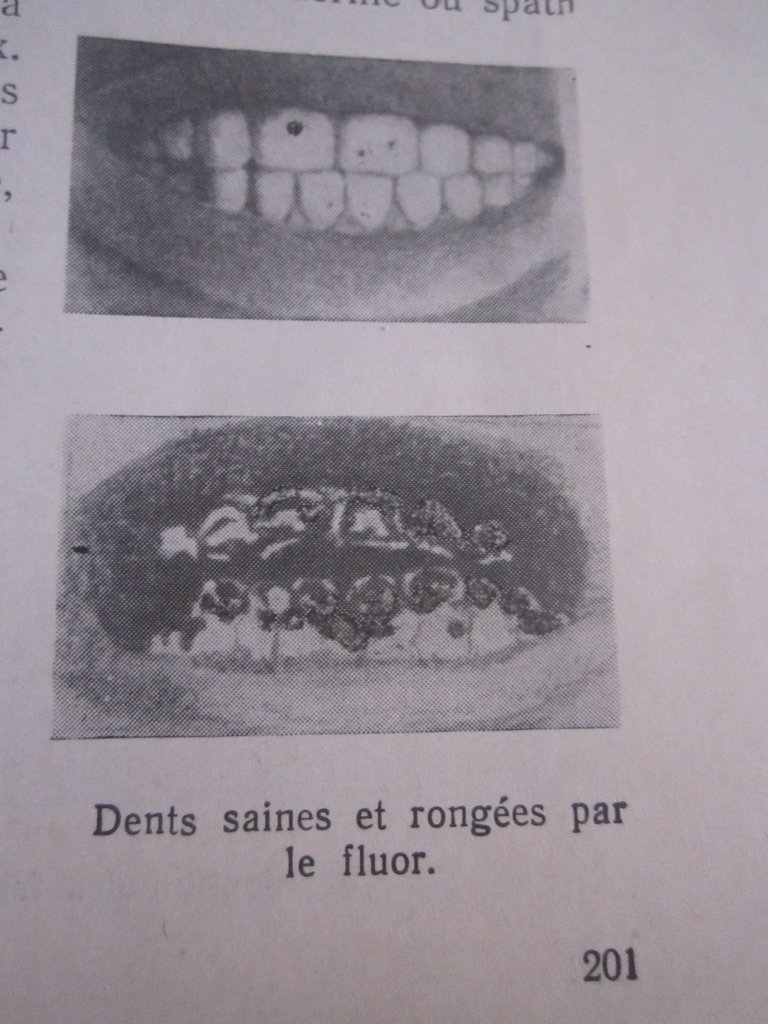
Le fluor n'est pas dangereux s'il ne s'agit pas de concentrations élevées, où le risque est lié à sa concentration et à sa durée d'utilisation:
- La consommation de fortes concentrations de fluorure pour de longues périodes peut causer une fluorose dentaire, et la fluorose squelettique.
Photo prise de livre: La géochimie récréative, G.Fresman 1958
Par conséquent, l'UNICEF a classé la fluoration comme un problème mondial en raison de problèmes de santé causés par cette substance dans de nombreux pays, où au moins 25 pays souffrent de problèmes de fluoration, ce qui signifie des dizaines de millions de personnes infectées par la fluorose; 2.7 millions de personnes en Chine seulement ont été paralysées et handicapées par cette maladie.
Pourquoi ces pays n'ont-ils pas trouvé de solution?
Le processus de retrait de l'excès de fluorure de l'eau est un processus très difficile et coûteux, de sorte que certains pays ne peuvent pas se le permettre, et pour ce processus, les solutions à faible coût n'existent pas.
Réferences:
La géochimie récréative, G.Fresman
Utilisation du fluor dans la prévention de la carie dentaire avant l'age de 18ans, agence francaise de sécurité sanitaire des profuits de santé, octobre 2008
Le fluor et la santé des dents chez l'enfant, Héléne Roy, CHU sainte-justine
Fluorine, wikipedia
Chers steems merci pour la lecture
Si vous aimez cet article upvoter et suivez Pour être informé des prochains articles.
S'il y a des commentaires, des critiques ou des informations supplémentaires, écrivez-les s'il vous plaît.-
Mes salutations
@Benainouna



Trés bel article tellement détaillé mais juste une petite remarque, tu as mentionné
Tu as trompé sur cela, c'est le 17éme et non pas le septième :p On dirait après un tel article tu as droit à faire ces erreurs de frappe :pVotre connaissance est large et cela me rend plus honoré de vous connaître ;) , Bravo et merci encoreah Merci beaucoup pour la note @francybrothers :) faute de frappe je voulais dire dix-septiéme.
Un excellent post, très complet et bien documenté ! Félicitations ;-) Quand je pense qu'ils donnaient du fluor aux enfants à la cuillère à l'époque, je pense que beaucoup ont connus des surdoses... Pour ma part j'ai arrêté le dentifrice au fluor, et je ne m'en porte pas plus mal. A bientôt pour le prochain post ;-)
Je confirme, je suis d'une époque où tous les matins, à l'école, on était obligé de prendre une pilule de fluor. C'est quelques années après la fin de ma scolarité qu'ils se sont rendus compte que ce n'était pas si sain que ça.
On nous cache tout, on nous dit rien. 😩
je vous souhaite meilleurs voeux de bonheur et de santé :) , A bientôt.Merci @yann85 :) , et oui sa fait mal que certains pays ajoutent encore du fluor dans l'eau potable malgré les avertissements des organismes de santé.