Carbonic acid (H2CO3) is an extremely weak acid that comes from limestone rocks. This, industrially, serves as ingredients for soft drinks, carbonated soft drinks, for the production of carbonates with other minerals, effervescent tablets, arc welding, as a component of fire extinguishers, for refrigeration chambers, such as dry ice, etc., that is, It is widely used and can fulfill different functions in people's lives, but how can we produce carbonic acid?
As we know, air is composed of approximately 21% oxygen (O2) and 79% nitrogen (N2) but this is an approximation to the ideality since oxygen and nitrogen are the components that are found on a larger scale in the air, however, this consists of a little Argon, Carbon dioxide, Neon, Helium, Hydrogen, water vapor, etc., in the case of carbon dioxide, which is one of the gases that is involved in greenhouse gases , it can react with rainwater forming carbonic acid and this, in turn, reacting with rocks from lakes and rivers with alkaline earth metal ions to form carbonates that give the water a property of hardness. That is, if we react a quantity of said gas with water we have carbonic acid as a reaction product, but how can we do it in an easy and simple way?
Industrially, carbon dioxide is very versatile and the human being has used it for the production of beverages, fire extinguishers, to form foams, among other uses; but one way to obtain this gas could be using pills that have the ability to make effervescence as ENO Seltzer, Alka Seltzer or simply sodium bicarbonate. For example, a person who has stomach pain takes some sodium bicarbonate in water and begins to release gases. What happens here? Sodium bicarbonate reacts with gastric acids and this produces carbon dioxide and water through the reaction:
NaHCO3 + HCl --> NaCl + CO2 + H2O
So, why not recreate this experience easily. By performing a simple laboratory practice we can achieve it.
INSTRUMENTS:
- 2 Erlenmeyer flasks
- A plastic hose
- Aluminum foil
- Effervescent tablet
- Thread
- Scissors
- Concentrated hydrochloric acid
- Distilled water
- pH-meter
- Gloves
- Lab coat
- Protection glasses
- Graduated cylinder
In a 250ml Erlenmeyer flask, 20 ml of hydrochloric acid (HCl) are added and an effervescent tablet is passed through with a piece of thread and tied, the Fiola is covered with a little aluminum foil and a hose is inserted. plastic without having contact with the solution inside, said hose will be connected to another Fiola that contains water. What happens now? If we lower the thread and put the tablet in contact with the hydrochloric acid it will begin to effervesce and release carbon dioxide, which is odorless and colorless, and pass through the hose to the other Fiola and react, by bubbling, with water forming carbonic acid.
Immediately after finishing the experiment, the pH of the solution can be measured with water and tabulated to determine the carbonic acid fraction in the water. Now let's analyze the experiment.
The chemical balance that exists between carbonic acid and water is:
(1) CO2 + H2O ↔ H2CO3
(2) H2CO3 ↔ HCO3 + H
(3) HCO3 ↔ CO3 + H
And as we can notice we have 4 species in the solution that are balanced and coexist together. But how can we determine the amount of carbonic acid produced? Well, this is where the equilibrium constants and the measured pH come in. The equilibrium constants are written in the form:
K1=[H2CO3 ]/[CO2] =1,07031x10^(-3)
K2=[HCO3][H]/[H2CO3 ] =3,976596x10^(-4)
K3=[CO3][H]/[HCO3] =4,082735x10^(-11)
And basically, with them we can relate the amount that exists in a reversible reaction of the products and the reagents. Let's say that in a particular reaction the equilibrium constant is much greater than 1, this means that the solution favors the formation of products, however, if the constant is much less than 1 what it means is that the reaction is favored to the formation of the reagents, but if the constant is equal to the unit, it means that there is the same number of products as there are reagents.
On the other hand, mole fraction in a solution is simply the quotient between the moles of a particular compound and the total moles of the solution, of the form:
Xi=moles del compuesto i / moles totales en solución
In addition, we know that the moles of a compound can be calculated if we multiply the volume of the solution by its concentration, in the following way:
Moles del compuesto i= [compuesto i] x Volumen solución
And if we relate this with the previous equations we obtain that the molar fraction of a component is given by:
Xi=[compuesto i]/([compuesto i]+[compuesto a]+[compuesto b])
So, we can say that the molar fraction of carbonic acid and others in aqueous solution is:
X(H2CO3)=[H2CO3]/([H2CO3 ]+[CO2]+[HCO3]+[CO3])
X(CO2)=[CO2]/([H2CO3 ]+[CO2]+[HCO3]+[CO3])
X(HCO3 )=[HCO3]/([H2CO3 ]+[CO2]+[HCO3]+[CO3])
X(CO3)=[CO3]/([H2CO3 ]+[CO2]+[HCO3]+[CO3])
And with the help of the equilibrium constants and with the definition of the pH that is not more than the logarithm of the concentration of protons in the solution, we obtain that:
X(H2CO3)=[(10^(-pH)/K2)]/([(10^(-pH))/K2][(1/K1)+1]+(1+[K3/10^(-pH)]))
X(CO2)=(10^(-pH)/(K1×K2))/([(10^(-pH))/K2][(1/K1)+1]+(1+[K3/10^(-pH)]))
X(HCO3)=1/([(10^(-pH))/K2][(1/K1)+1]+(1+[K3/10^(-pH)]))
X(CO3)=(K3/10^(-pH))/([(10^(-pH))/K2][(1/K1)+1]+(1+[K3/10^(-pH)]))
Finally, we can determine the amount of carbonic acid in the water by reacting carbon dioxide and water, taking into account the pH of the solution. In addition, if we take different amounts of the effervescent tablet and make it react with hydrochloric acid we can create a table of values where we could observe how the mole fraction of its components varies with respect to pH. If we go further, we could graph those values and see how they all behave in solution.
Scientists have concluded that among all the species involved in this process, only two are those that are found at a higher rate. Is this true? Well, if we have enough data we could check it.
SOURCE: 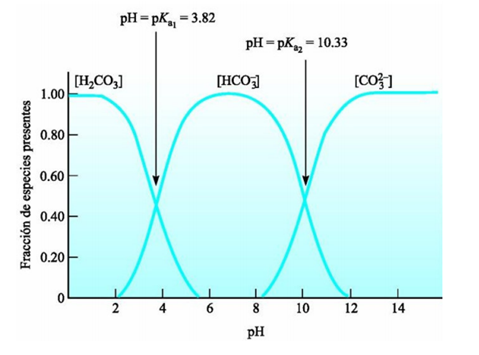
· http://noticias-ciencia.com/para-que-sirve-el-dioxido-de-carbono/
¿Que tan difícil es cuantificar el ácido carbónico proveniente de la reacción química entre el CO2 y agua?
El ácido carbónico (H2CO3) es un ácido extremadamente débil que es procedente de rocas calizas. Este, industrialmente, sirve como ingredientes para bebidas gaseosas, refrescos carbonatados, para la producción de carbonatos con otros minerales, pastillas efervescentes, soldadura al arco, como componente de extintores, para cámaras de refrigeración, como hielo seco, etc., es decir, que es muy utilizado y puede cumplir distintas funciones en la vida de las personas, pero ¿cómo podemos producir ácido carbónico?

Como sabemos, el aire esta compuesto aproximadamente 21% oxigeno (O2) y 79% nitrógeno (N2) pero esto es una aproximación a la idealidad ya que el oxígeno y el nitrógeno son los componentes que se encuentran a mayor escala en el aire, sin embargo este consta de un poco de Argón, Dióxido de carbono, Neón, Helio, Hidrógeno, vapor de agua, etc., en el caso del Dióxido de carbono, que es uno de los gases que se encuentra involucrado en los gases del efecto invernaderos, puede reaccionar con el agua de lluvia formando ácido carbónico y este, a su vez reaccionando con piedras y/o rocas de lagos y ríos con iones de metales alcalinotérreos para formar carbonatos que son los que les dan al agua un propiedad de dureza. Es decir, que si se hacemos reaccionar una cantidad de dicho gas con agua tenemos como producto de reacción ácido carbónico, pero ¿Cómo poder hacerlo de una manera fácil y sencilla?
Industrialmente, el dióxido de carbono es muy versátil y el ser humano lo ha utilizado por la producción de bebidas, extintores de incendio, para formar espumas, entre otros usos; pero una forma de obtener este gas podría ser utilizando pastillas que tenga la capacidad de hacer efervescencia como ENO Seltzer, Alka Seltzer o simplemente bicarbonato de sodio. Por ejemplo, una persona que tiene dolor estomacal toma un poco de bicarbonato de sodio en agua y comienza a liberar gases ¿Qué pasa aquí? El bicarbonato de sodio reacciona con los ácidos gástricos y este produce dióxido de carbono y agua mediante la reacción:
NaHCO3 + HCl --> NaCl + CO2 + H2O
Entonces, por que no recrear esta experiencia fácilmente. Realizando una práctica de laboratorio sencilla lo podemos lograr.
INSTRUMENTOS:
- 2 Fiolas Erlenmeyer de 250 ml
- Una manguera de plástica
- Papel aluminio
- Pastilla efervescente
- Hilo
- Tijera
- Ácido clorhídrico concentrado
- Agua destilada
- pH-meter
- Guantes
- Bata de laboratorio
- Lentes de protección
- Cilindro graduado
En una Fiola Erlenmeyer de 250ml se añaden 20 ml de ácido clorhídrico (HCl) y a una pastilla de efervescente se le atraviesa con un trozo de hilo y se amarra, se tapa la Fiola con un poco de papel aluminio y se le introduce una manguera de plástico sin tener contacto con la solución en su interior, dicha manguera estará conectada a otra Fiola que contiene agua ¿Qué pasa ahora? Si bajamos el hilo y ponemos en contacto la pastilla con el ácido clorhídrico este comenzara a hacer efervescencia y desprenderá dióxido de carbono, que es inodoro e incoloro, y pasara a través de la manguera hasta llegar a la otra Fiola y reaccionara, mediante burbujeo, con el agua formando ácido carbónico.
Inmediatamente de haber terminado el experimento se puede medir el pH de la solución con agua y tabularlo para determinar la fracción de acido carbónico en el agua. Ahora analicemos el experimento.
El equilibrio químico que existe entre el acido carbónico y el agua es:
(1) CO2 + H2O ↔ H2CO3
(2) H2CO3 ↔ HCO3 + H
(3) HCO3 ↔ CO3 + H
Y como podemos notar tenemos 4 especies en la solución que se encuentran equilibrio y coexisten juntas. pero ¿cómo podemos determinar la cantidad de acido carbónico producido? Bueno, aquí es donde entran las constantes de equilibrio y el pH medido. Las constantes de equilibrio vienen escritas de la forma:
Keq=Productos/Reactivos
K1=[H2CO3 ]/[CO2] =1,07031x10^(-3)
K2=[HCO3][H]/[H2CO3 ] =3,976596x10^(-4)
K3=[CO3][H]/[HCO3] =4,082735x10^(-11)
Y básicamente, con ellas podemos relacionar la cantidad que existe en una reacción reversible de los productos y los reactivos. Digamos que en una reacción particular la constante de equilibrio es mucho mayor que 1, esto quiere decir que en solución se favorece a la formación de productos, sin embargo, si la constante es mucho meno que 1 lo que significa es que la reacción esta favorecida a la formación de los reactivos, pero si la constante es igual a la unidad significa que existe la misma cantidad de productos que de reactivos.
Por otro lado, fracción molar en una solución es simplemente el cociente entre los moles de un compuesto en particular y los moles totales de la solución, de la forma:
Xi=moles del compuesto i / moles totales en solución
Además, conocemos que los moles de un compuesto pueden ser calculado si multiplicamos el volumen de la solución por su concentración, de la forma:
Moles del compuesto i= [compuesto i] x Volumen solución
Y si relacionamos esto con las ecuaciones anteriores obtenemos que la fracción molar de un componente viene dado por:
Xi=[compuesto i]/([compuesto i]+[compuesto a]+[compuesto b])
Entonces, podemos decir que la fracción molar del ácido carbónico y demás en solución acuosa es:
X(H2CO3)=[H2CO3]/([H2CO3 ]+[CO2]+[HCO3]+[CO3])
X(CO2)=[CO2]/([H2CO3 ]+[CO2]+[HCO3]+[CO3])
X(HCO3 )=[HCO3]/([H2CO3 ]+[CO2]+[HCO3]+[CO3])
X(CO3)=[CO3]/([H2CO3 ]+[CO2]+[HCO3]+[CO3])
Y con ayuda de las constantes de equilibrio y con la definición del pH que no es mas que el menos logaritmo de la concentración de protones en la solución, obtenemos que:
X(H2CO3)=[(10^(-pH)/K2)]/([(10^(-pH))/K2][(1/K1)+1]+(1+[K3/10^(-pH)]))
X(CO2)=(10^(-pH)/(K1×K2))/([(10^(-pH))/K2][(1/K1)+1]+(1+[K3/10^(-pH)]))
X(HCO3)=1/([(10^(-pH))/K2][(1/K1)+1]+(1+[K3/10^(-pH)]))
X(CO3)=(K3/10^(-pH))/([(10^(-pH))/K2][(1/K1)+1]+(1+[K3/10^(-pH)]))
Finalmente, podemos determinar que cantidad hay de acido carbónico en el agua mediante la reacción de dióxido de carbono y agua, tomando en cuenta el pH de la solución. Además, si tomamos distintas cantidades de la pastilla efervescente y la hacemos reaccionar con el ácido clorhídrico podremos crear una tabla de valores donde podríamos observar como varia la fracción molar de sus componentes respecto al pH. Si vamos mas allá, podríamos graficar esos valores y ver como se comportan todos ellos en solución.
Científicos han concluido que en entre todas las especies involucradas en este proceso solo dos son las que se encuentran a mayor proporción ¿será cierto? Pues si tenemos suficientes datos lo podríamos comprobar.

FUENTE:
- https://previa.uclm.es/profesorado/pablofernandez/QG-05-equilibrio%20acido%20base/equilibrio%20acido%20base.pdf
- http://noticias-ciencia.com/para-que-sirve-el-dioxido-de-carbono/
Congratulations @saren96! You have completed some achievement on Steemit and have been rewarded with new badge(s) :
Click on the badge to view your Board of Honor.
If you no longer want to receive notifications, reply to this comment with the word
STOPHi there!! Thanks